Oxidación avanzada, fotocatálisis
Publicado: 7 de julio de 2008
Fuente: TECNOZONO SA
La empresa Tecnozono está presentando en la Industria Nacional, el uso de la oxidación fotocatalítica, para el tratamiento de efluentes líquidos tal como los condensados que entrega la planta evaporadora, con el objetivo de obtener un agua con calidad para uso industrial, dándole con esto un valor agregado a un residuo, apoyando en los planes de producción limpia de las empresas. El sistema emplea como oxidante al ozono, el catalizador es dióxido de titanio y la fuente de luz son lámparas UV.
INTRODUCCION
El tratamiento de los residuos líquidos puede ser un problema muy complejo debido a la gran variedad de químicos y sus niveles de concentración. A partir de las investigaciones realizadas acerca de los efectos de ciertos contaminantes, se han generado nuevas tecnologías, entre las cuales cabe mencionar el tratamiento de oxidación avanzada, el cual en algunos casos presenta ventajas sobre las técnicas comúnmente utilizadas como el tratamiento primario y secundario. Estos tratamientos, en especial los secundarios, permiten disminuir la alta carga orgánica bajando la DQO y la DBO de los efluentes, pero son ineficaces en la eliminación del color y toxicidad debido a la presencia de estructuras polifenólicas. Por otro lado, estos tratamientos son muy sensibles a los parámetros de operación tales como pH, temperatura y presencia de tóxicos que pueden inhibir la actividad microbiológica.
¿Qué hace la oxidación avanzada?
Esta tecnología degrada sistemáticamente los compuestos presentes en el agua, oxidándolos y reduciéndolos, pudiendo llegar incluso a la mineralización total, es decir la obtención de CO2, agua y ácidos minerales, dependiendo del tiempo de contacto y otras variables.
¿Cómo funciona la oxidación avanzada?
En términos muy simplificados, los compuestos contenidos en el agua son atacados por elementos altamente reactivos, que los transforman una y otra vez, pasando por compuestos intermedios, hasta llegar a las formas más simples.
La oxidación avanzada es una buena alternativa a emplear en algunos riles, un caso es previo a un tratamiento biológico, para aumentar su biodegradabilidad y disminuir su toxicidad, cuando sus componentes afectan negativamente a los microorganismos que degradarán la materia orgánica.
La oxidación avanzada dispone de una amplia gama de procesos que utilizan diferentes oxidantes enérgicos como peróxido de hidrógeno, ozono, hipoclorito, radiación ultra violeta o la combinación de dos o más de estos reactivos, para la degradación de estas aguas residuales.
Esta tecnología permite destruir compuestos orgánicos persistentes o refractarios que están contenidos en residuos industriales líquidos.
TECNOZONO SA, han realizado estudios a nivel piloto, con oxidación avanzada, donde han verificado que la destrucción de una cierta concentración de fenoles en la celulosa se puede lograr en sólo 5 minutos, a diferencia de un tratamiento biológico común, que puede demorar hasta 12 horas en la destrucción de la misma concentración, lo que también conlleva una disminución en el volumen requerido de reactores, demostrado que a nivel industrial se necesitaría un reactor de sólo 8 m3, para tratar un mismo ril en 1.152 m3 que se requerirían para una aplicación de un tratamiento biológico.
Como puede observarse, la oxidación avanzada tiene ventajas en la velocidad de degradación y en el tamaño de las instalaciones necesarias para el tratamiento, incidiendo esto último en una menor inversión. Otra ventaja de estos sistemas es la nula o escasa generación de lodos como resultado del tratamiento, lo que elimina un problema para su disposición final.
Como cualquier tratamiento de riles, la oxidación avanzada requiere de un tratamiento primario previo, principalmente para evitar que los residuos sólidos obstruyan la columna donde se realiza la reacción. Dado que estos sistemas operan mejor en condiciones neutras o alcalinas, puede ser necesaria una etapa de neutralización.

FUNDAMENTOS DE LA OXIDACION AVANZADA
Para el caso del TiO2, sometido a radiación con una longitud de onda inferior de 400 nm, se genera un exceso de electrones en la banda de conducción y huecos positivos h+ en la banda de valencia (reacción 17).
En la superficie del TiO2, los huecos reaccionan tanto con H2O absorbida (reacción 18) como con grupos OH- (reacción 19) para formar radicales hidroxilo (OHº).
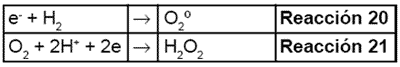
Por su parte, los electrones en exceso de la banda de conducción reaccionan con el oxígeno molecular para formar radicales súper óxido (reacción 20) y peróxido de hidrógeno (reacción 21.

Los tratamientos de oxidación avanzada pueden definirse como procesos que implican la formación de radicales hidroxilo (OHº) altamente reactivos, ya que presentan un elevado potencial de oxidación (Eº = 2.8 V), característica que lo hace muy efectivos para la oxidación de compuestos orgánicos, principalmente por abstracción de hidrógeno. Es decir, lo primero es la generación de radicales hidroxilos, los que reaccionan sobre la materia orgánica, para formar radicales orgánicos libres (reacción 1), los que pueden reaccionar con oxígeno molecular para formar peroxiradicales (reacción 2); dependiendo del tiempo de contacto, se puede inducir reacciones de oxidación en serie, que pueden conducir a la mineralización completa de los compuestos orgánicos, dependiendo de la calidad final que se desea obtener en el efluente.
Las principales ventajas de los tratamientos de oxidación avanzada son:
INTRODUCCION
El tratamiento de los residuos líquidos puede ser un problema muy complejo debido a la gran variedad de químicos y sus niveles de concentración. A partir de las investigaciones realizadas acerca de los efectos de ciertos contaminantes, se han generado nuevas tecnologías, entre las cuales cabe mencionar el tratamiento de oxidación avanzada, el cual en algunos casos presenta ventajas sobre las técnicas comúnmente utilizadas como el tratamiento primario y secundario. Estos tratamientos, en especial los secundarios, permiten disminuir la alta carga orgánica bajando la DQO y la DBO de los efluentes, pero son ineficaces en la eliminación del color y toxicidad debido a la presencia de estructuras polifenólicas. Por otro lado, estos tratamientos son muy sensibles a los parámetros de operación tales como pH, temperatura y presencia de tóxicos que pueden inhibir la actividad microbiológica.
¿Qué hace la oxidación avanzada?
Esta tecnología degrada sistemáticamente los compuestos presentes en el agua, oxidándolos y reduciéndolos, pudiendo llegar incluso a la mineralización total, es decir la obtención de CO2, agua y ácidos minerales, dependiendo del tiempo de contacto y otras variables.
¿Cómo funciona la oxidación avanzada?
En términos muy simplificados, los compuestos contenidos en el agua son atacados por elementos altamente reactivos, que los transforman una y otra vez, pasando por compuestos intermedios, hasta llegar a las formas más simples.
La oxidación avanzada es una buena alternativa a emplear en algunos riles, un caso es previo a un tratamiento biológico, para aumentar su biodegradabilidad y disminuir su toxicidad, cuando sus componentes afectan negativamente a los microorganismos que degradarán la materia orgánica.
La oxidación avanzada dispone de una amplia gama de procesos que utilizan diferentes oxidantes enérgicos como peróxido de hidrógeno, ozono, hipoclorito, radiación ultra violeta o la combinación de dos o más de estos reactivos, para la degradación de estas aguas residuales.
Esta tecnología permite destruir compuestos orgánicos persistentes o refractarios que están contenidos en residuos industriales líquidos.
TECNOZONO SA, han realizado estudios a nivel piloto, con oxidación avanzada, donde han verificado que la destrucción de una cierta concentración de fenoles en la celulosa se puede lograr en sólo 5 minutos, a diferencia de un tratamiento biológico común, que puede demorar hasta 12 horas en la destrucción de la misma concentración, lo que también conlleva una disminución en el volumen requerido de reactores, demostrado que a nivel industrial se necesitaría un reactor de sólo 8 m3, para tratar un mismo ril en 1.152 m3 que se requerirían para una aplicación de un tratamiento biológico.
Como puede observarse, la oxidación avanzada tiene ventajas en la velocidad de degradación y en el tamaño de las instalaciones necesarias para el tratamiento, incidiendo esto último en una menor inversión. Otra ventaja de estos sistemas es la nula o escasa generación de lodos como resultado del tratamiento, lo que elimina un problema para su disposición final.
Como cualquier tratamiento de riles, la oxidación avanzada requiere de un tratamiento primario previo, principalmente para evitar que los residuos sólidos obstruyan la columna donde se realiza la reacción. Dado que estos sistemas operan mejor en condiciones neutras o alcalinas, puede ser necesaria una etapa de neutralización.

FUNDAMENTOS DE LA OXIDACION AVANZADA
Para el caso del TiO2, sometido a radiación con una longitud de onda inferior de 400 nm, se genera un exceso de electrones en la banda de conducción y huecos positivos h+ en la banda de valencia (reacción 17).
En la superficie del TiO2, los huecos reaccionan tanto con H2O absorbida (reacción 18) como con grupos OH- (reacción 19) para formar radicales hidroxilo (OHº).
Por su parte, los electrones en exceso de la banda de conducción reaccionan con el oxígeno molecular para formar radicales súper óxido (reacción 20) y peróxido de hidrógeno (reacción 21.
Los tratamientos de oxidación avanzada pueden definirse como procesos que implican la formación de radicales hidroxilo (OHº) altamente reactivos, ya que presentan un elevado potencial de oxidación (Eº = 2.8 V), característica que lo hace muy efectivos para la oxidación de compuestos orgánicos, principalmente por abstracción de hidrógeno. Es decir, lo primero es la generación de radicales hidroxilos, los que reaccionan sobre la materia orgánica, para formar radicales orgánicos libres (reacción 1), los que pueden reaccionar con oxígeno molecular para formar peroxiradicales (reacción 2); dependiendo del tiempo de contacto, se puede inducir reacciones de oxidación en serie, que pueden conducir a la mineralización completa de los compuestos orgánicos, dependiendo de la calidad final que se desea obtener en el efluente.
Las principales ventajas de los tratamientos de oxidación avanzada son:
- Capacidad potencial para llevar a cabo una profunda mineralización de los contaminantes orgánicos y oxidación de los compuestos inorgánicos hasta dióxido de Carbono e iones (cloruros, nitratos).
- Reactividad con la mayoría de compuestos orgánicos, hecho principalmente interesante si se quiere evitar la presencia de subproductos potencialmente tóxicos presentes en los contaminantes originales, que pueden crearse mediante otros métodos.
Descomposición de los reactivos utilizados como oxidantes en productos inocuos. - La presencia de un catalizador en los procesos de oxidación avanzada permite generar especies muy reactivas a partir de un oxidante como el ozono, logrando que los procesos se lleven a caboen forma mucho más rápida que en una oxidación avanzada tradicional, lo que puede aún acelerarse más si se irradia con fotones a través de luz UV. Se denomina Oxidación fotocatalítica al sistema que emplea en conjunto la radiación UV, un catalizador y un oxidante.
FUNDAMENTOS DE LA OXIDACION FOTOCATALITICA
La materia puede interactuar con la luz en un amplio rango de longitudes de onda y con diversos cambios en la estructura de las moléculas. Las radiaciones cerca al espectro visible o ultravioleta (240-700nm) interactúan con los electrones de una molécula y estas reacciones son las más importantes desde el punto de vista ambiental.
La interacción de la luz con materia se da a escala molecular, donde ésta interactúa con un fotón entregado por la luz (reacción 3), excitándose. A representa el estado fundamental de la molécula, hv es el fotón absorbido y Aº la molécula en estado excitado.
Para que los procesos de oxidación fotocatalítica se inicien, es imperativa la presencia de radicales libres, lo que conlleva la necesidad de incorporar agentes oxidantes que permiten la formación de tales radicales; los oxidantes más reconocidos y utilizados son el peróxido de hidrógeno y el ozono. Entre los distintos procesos de aplicación para el tratamiento de aguas, la combinación de radiación ultravioleta y ozono es muy interesante cuando se desea un agua con un alto grado de pureza. Este proceso implica la formación de radicales hidroxilo. Como se mencionó anteriormente, el ozono es un potente agente oxidante no selectivo y una excelente fuente de radicales libres; es además un aditivo deseable ecológicamente ya que durante su descomposición únicamente se genera oxígeno.
Entre los catalizadores industriales, el más ampliamente usado en aplicaciones fotocatalíticas es el dióxido de titanio (en una de sus estructuras), ya que presenta una mayor actividad fotocatalítica, no es tóxico, es estable en soluciones acuosa y no es costoso. Adicionalmente dióxido de titanio es un sólido semiconductor, por lo que al ser activado por la absorción de la luz acelera el proceso interaccionando con el reactivo a través de la aparición de pares electrón-hueco (e- y h+). Así los electrones excitados son transferidos hacia la especie reducible, a la vez que el catalizador acepta electrones de la especie oxidable que ocupará los huecos; de esta forma el flujo neto de electrones será nulo y el catalizador permanecerá inalterado.
Como se ha mencionado anteriormente, en los procesos de oxidación avanzada tradicionales se cree que el radical OHº es la principal especie oxidante, responsable de la degradación de la mayoría de los compuestos orgánicos estudiados; en el caso del empleo del TiO2 el proceso de degradación mediante transferencia electromagnética ha sido de mucho interés por los huecos (h+) producidos en la banda de valencia del semiconductor.
En la siguiente figura se esquematiza el proceso de fotocatálisis:
Para el caso del TiO2, sometido a radiación con una longitud de onda inferior de 400 nm, se genera un exceso de electrones en la banda de conducción y huecos positivos h+ en la banda de valencia (reacción 17).

En la superficie del TiO2, los huecos reaccionan tanto con H2O absorbida (reacción 18) como con grupos OH- (reacción 19) para formar radicales hidroxilo (OHº).
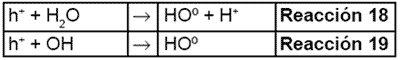
Por su parte, los electrones en exceso de la banda de conducción reaccionan con el oxígeno molecular para formar radicales superóxido (reacción 20) y peróxido de hidrógeno (reacción 21).
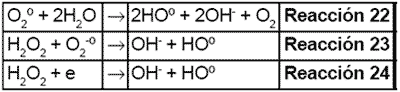
Tanto el radical superóxido como el peróxido de hidrógeno generan más radicales hidroxilos mediante las siguientes reacciones:
Parámetros que influyen en el proceso de Fotocatálisis con TiO2 :
Existen varios parámetros que influyen cualitativa y cuantitativamente en el proceso de oxidorreducción fotocatalítico. A continuación se presentan los más importantes:
La materia puede interactuar con la luz en un amplio rango de longitudes de onda y con diversos cambios en la estructura de las moléculas. Las radiaciones cerca al espectro visible o ultravioleta (240-700nm) interactúan con los electrones de una molécula y estas reacciones son las más importantes desde el punto de vista ambiental.
La interacción de la luz con materia se da a escala molecular, donde ésta interactúa con un fotón entregado por la luz (reacción 3), excitándose. A representa el estado fundamental de la molécula, hv es el fotón absorbido y Aº la molécula en estado excitado.
Para que los procesos de oxidación fotocatalítica se inicien, es imperativa la presencia de radicales libres, lo que conlleva la necesidad de incorporar agentes oxidantes que permiten la formación de tales radicales; los oxidantes más reconocidos y utilizados son el peróxido de hidrógeno y el ozono. Entre los distintos procesos de aplicación para el tratamiento de aguas, la combinación de radiación ultravioleta y ozono es muy interesante cuando se desea un agua con un alto grado de pureza. Este proceso implica la formación de radicales hidroxilo. Como se mencionó anteriormente, el ozono es un potente agente oxidante no selectivo y una excelente fuente de radicales libres; es además un aditivo deseable ecológicamente ya que durante su descomposición únicamente se genera oxígeno.
Entre los catalizadores industriales, el más ampliamente usado en aplicaciones fotocatalíticas es el dióxido de titanio (en una de sus estructuras), ya que presenta una mayor actividad fotocatalítica, no es tóxico, es estable en soluciones acuosa y no es costoso. Adicionalmente dióxido de titanio es un sólido semiconductor, por lo que al ser activado por la absorción de la luz acelera el proceso interaccionando con el reactivo a través de la aparición de pares electrón-hueco (e- y h+). Así los electrones excitados son transferidos hacia la especie reducible, a la vez que el catalizador acepta electrones de la especie oxidable que ocupará los huecos; de esta forma el flujo neto de electrones será nulo y el catalizador permanecerá inalterado.
Como se ha mencionado anteriormente, en los procesos de oxidación avanzada tradicionales se cree que el radical OHº es la principal especie oxidante, responsable de la degradación de la mayoría de los compuestos orgánicos estudiados; en el caso del empleo del TiO2 el proceso de degradación mediante transferencia electromagnética ha sido de mucho interés por los huecos (h+) producidos en la banda de valencia del semiconductor.
En la siguiente figura se esquematiza el proceso de fotocatálisis:
Para el caso del TiO2, sometido a radiación con una longitud de onda inferior de 400 nm, se genera un exceso de electrones en la banda de conducción y huecos positivos h+ en la banda de valencia (reacción 17).
En la superficie del TiO2, los huecos reaccionan tanto con H2O absorbida (reacción 18) como con grupos OH- (reacción 19) para formar radicales hidroxilo (OHº).

Por su parte, los electrones en exceso de la banda de conducción reaccionan con el oxígeno molecular para formar radicales superóxido (reacción 20) y peróxido de hidrógeno (reacción 21).

Tanto el radical superóxido como el peróxido de hidrógeno generan más radicales hidroxilos mediante las siguientes reacciones:

Parámetros que influyen en el proceso de Fotocatálisis con TiO2 :
Existen varios parámetros que influyen cualitativa y cuantitativamente en el proceso de oxidorreducción fotocatalítico. A continuación se presentan los más importantes:
- Longitud de onda e intensidad de la luz: el aprovechamiento de la energía absorbida es mayor cuanto menor es la longitud de onda empleada.
- El catalizador: Cuanto mayor sea la dosis del catalizador, mayor será en principio la eficiencia obtenida, siempre que no empeore la turbidez ocasionada por sus partículas, dificultando la difusión de la luz ultravioleta.
- Efecto del oxígeno: La presencia de oxígeno es esencial para que se produzca una oxidación efectiva, ya que actúa como aceptor de los electrones liberados en la fotoexitación, evitando la recombinación del par hueco-electrón.
El oxigeno actúa como oxidante y se ha comprobado que cuando desaparece el oxígeno disuelto en el agua y no existe ninguna otra especie oxidante el proceso fotocatalítico, se detiene totalmente. - Temperatura y pH: La variación de la temperatura no afecta significativamente la velocidad de las reacciones fotocatalíticas. Aparentemente el pH no afecta notablemente este tratamiento ya que se han obtenido buenos resultados empleando TiO2 a diferentes rangos de pH, pero también se ha comprobado que éste afecta el tamaño de las partículas, la carga superficial y las posiciones de los máximos y mínimos de las bandas del TiO2 debido a su carácter anfotérico.
Debe trabajarse a un pH diferente al punto isoeléctrico para el TiO2 (pH 7), donde la superficie del óxido no está cargada. - Concentración inicial del contaminante: la velocidad de reacción varía proporcionalmente a la fracción de superficie cubierta por el sustrato.
- Calidad del agua a tratar: La presencia de turbidez, sólidos en suspensión y materia orgánica e inorgánica en el agua a tratar pueden restar eficiencia a la oxidación fotocatalítica con TiO2. La turbidez interfiere en la interacción de la luz ultravioleta y el catalizador, reduciendo la eficacia de la reacción de destoxificación.


Temas relacionados:
Recomendar
Comentar
Compartir
5 de julio de 2015
Se puede realizar este tratamiento en efluentes de Industria de fabricación de Papel Reciclado, ya q tiene una elevada carga orgánica, conductividad de 1500 uS...
Recomendar
Responder

2 de julio de 2015
De la capacidad innovadora humana depende el avance como el retroceso la destrucción o la preservación de las especies vivas como de todos los seres humanos.
Es por lo mismo que me interesa conocer este tipo de propuestas como otras paralelas desde las cuales es posible se continué produciendo esa polaridad.
Cuantas veces la lucha de intereses por lo regular va dirigida hacia acciones imperdonables de las empresas para obtener ganancias, como si pudieran escapar sus propietarios de consecuencias de las que tampoco podrán escapar cuando se equivocan.
Debiendo preguntarse si no les alcanzara ni a ellos mismos o bien al menos a sus propias futuras generaciones el haberse solo fijado en sus ganancias inmediatas..
Siendo el agua sin duda el principal recurso, el modelo de modelos de la naturaleza, que en estos tiempos y en los futuros desde los cuales los avances se generan en das y hasta en horas que gracias a la suma de revoluciones científicas y tecnológicas resulta muy delicado dar prioridad a la ganancia en lugar de la preservación de la vida en el planeta.
El grado en el que el Hombre siga siendo su propio principal depredador pues daña hasta hasta de su propia especie.
Cuantas veces a interpuesto la ganancia sin saber ver mas allá de sus narices . El genio de Nikola Tesla como De Alber Einstein que incluye Bucminster Fuller, Entre muchos otros a los que les a preocupado mas poner las en los que su verdadero éxito ha sido poner verdad y riqueza en su mente en lugar de la mente en la riqueza sin importar que sus ganancias y vanidad no sean la mejor y mas viable verdad autentica. Muchos otros aparentes grandes avances se revierten como enormes y hasta peligrosos retrocesos. principalmente por una posición en la que el dominio y el control les aseguran su aparente éxito en donde son las ganancias las que importan .
Es evidente que la verdadera Ciencia y la Tecnología , asì como son la esperanza de una mejor humanidad en complacencia múltiple en donde el ciclo del agua como liquido de la vida, como el elemento para incrementar la esperanza de vida humana, como el meta-modelo natural mas importante por lo que en mi humilde opinión no basta con parecer lo mas idóneo si no que ser y hacer y proponga integrando en forma especialmente sustentable la interacción de las disciplinas incidentes , porque afectar por ejemplo todos los cuerpos de agua en forma irremediable no tengo duda del exterminio humano y de muchos otros seres vivos.
Recomendar
Responder


Hy-Line International
Hy-Line International es una compañía genética de gallinas ponedoras, sus líneas estrella son Hy-Line W-80, Hy-Line w-36 y Hy-Line Brown
Enlace recomendado

14 de enero de 2010
podrian entregar mas datos por ejemplo cargas de entreda de los solidos supendidos o otros para analizar mas a fondo muy interesante el informe.
Recomendar
Responder

7 de mayo de 2009
El artículo me parece muy interesante, pero pregunto que eficiencia tendría para el tratamiento de riles de agua sangre, la luz ultravioleta realmente funcionaría.
Gracias
Recomendar
Responder

1 de febrero de 2008
Considero más que interesante el Articulo.
No se si puedo hacer ena consulta en en esta página.
Es utilizable esta tecnología de tratamiento, para el tratamiento de los efluentes industriales de una planta de Etanol (Vinaza)
Atte.
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.








