Leche suprema con ácidos caproico y linoleico altos y colesterol bajo producida con aceites y grasas en vacas Holstein-Friesian: metaanálisis
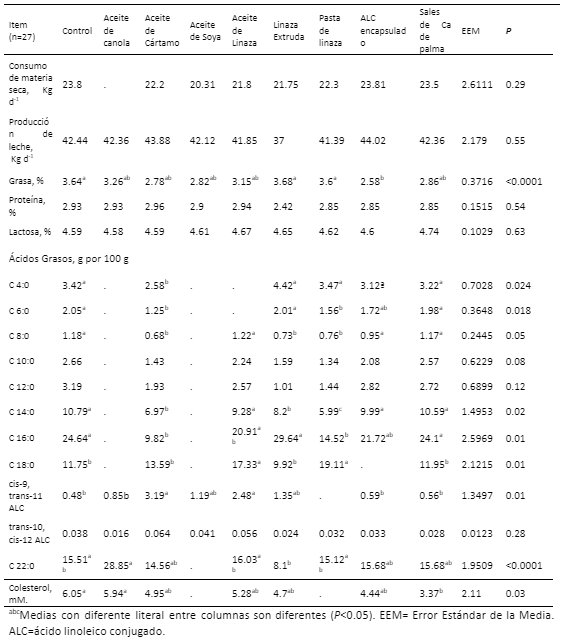
El objetivo fue analizar estudios publicados de experimentos realizados en condiciones controladas y cuantificar mediante metaanálisis los efectos de la complementación con aceites de canola, cártamo, soya y linaza, y linaza extruida, ALC encapsulado y sales de Ca de palma. En el estudio se utilizaron 27 artículos. Estos fueron obtenidos de Academia, CAB, Google Scholar, Pubmed, Redalyc, Sciencedirect, Scielo, Scirus, Scopus y Springer. El consumo de materia seca no fue significativo (P ≥ 0.05); como tampoco la PL (P ≥ 0.05). Por el contrario, la grasa fue menor (P ≤ 0.0001) con ALC encapsulado comparada con los demás suplementos (2.58 vs 2.78, 2.82, 2.86, 3.15. 3.26, 3.6, 3.64 y 3.68 g por 100 de AG, para los aceites de cártamo y soya, sales de Ca de palma, aceites de linaza y canola, pasta de linaza, Control y linaza extruida, respectivamente). En paralelo, la complementación no influyó (P ≥ 0.05) proteína y lactosa, y si influyó (P ≤ 0.05) los contenidos de ácidos butírico, caproico y caprilíco. No hubo efectos (P ≥ 0.05) en caprico y láurico y si hubo (P ≤ 0.05) para mirístico, palmítico y esteárico. Los aceites de cártamo y linaza incrementaron cis-9, trans-11, y no afectaron (P ≥ 0.05) al trans-10, cis-12. Por el contrario, se afectó (P ≤ 0.05) el ácido behénico y colesterol. En conclusión, la complementación con aceites de oleaginosas, ALC encapsulado, semillas tratadas térmicamente, y sales de Ca de palma incrementaron grasa, ácido caproico, cis-9, trans-11, y no influyeron en trans-10, cis-12. Los aceites de oleaginosas y las sales de palma reducen el colesterol de la leche.
Palabras clave: ácido linoleico conjugado, ácido caproico, colesterol, complementación, ácidos grasos, biohidrogenación, metaanálisis.
Introducción
Materiales y Métodos
Búsqueda de información
Criterios de inclusión o exclusión
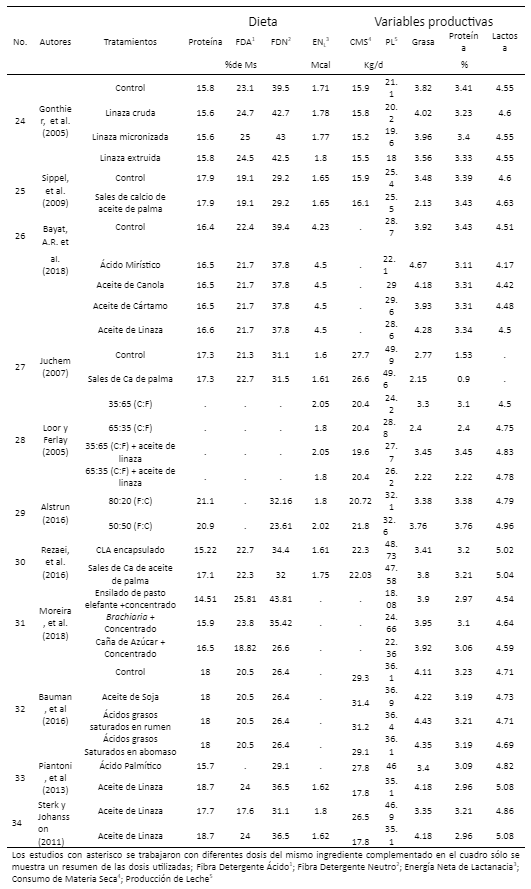
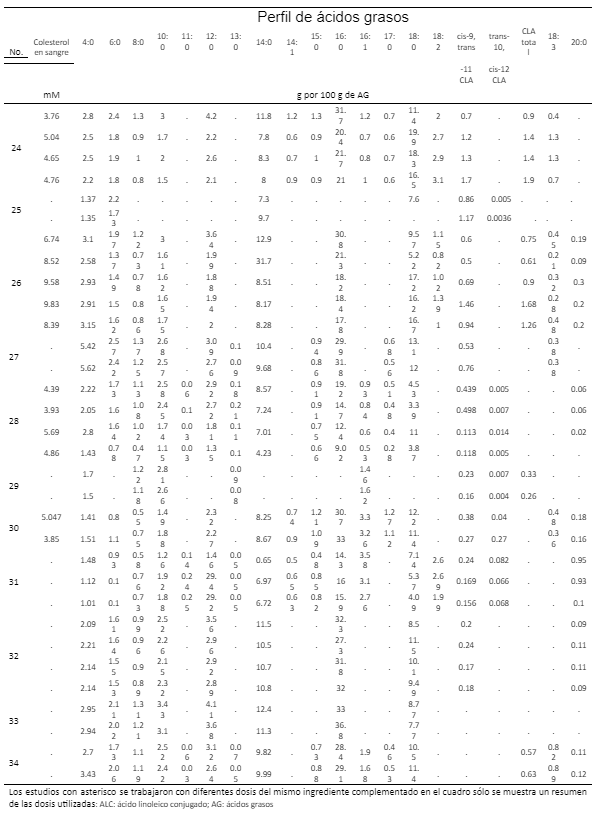
Variables evaluadas
Obtención de la información
Categorización de factores experimentales y contenido de ácidos grasos
Análisis estadístico
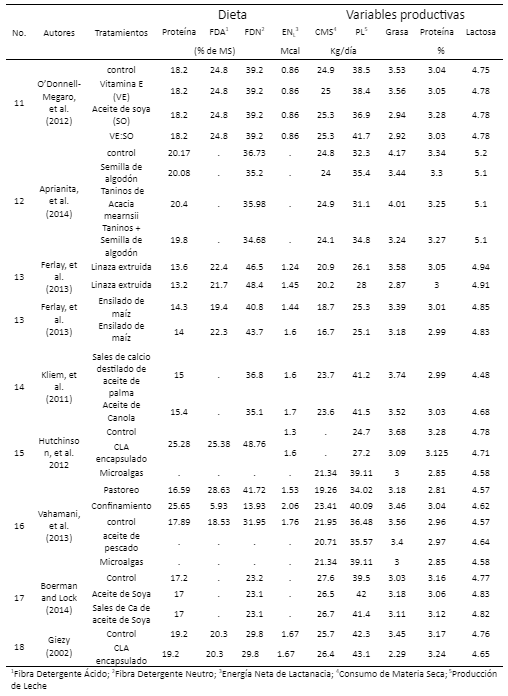
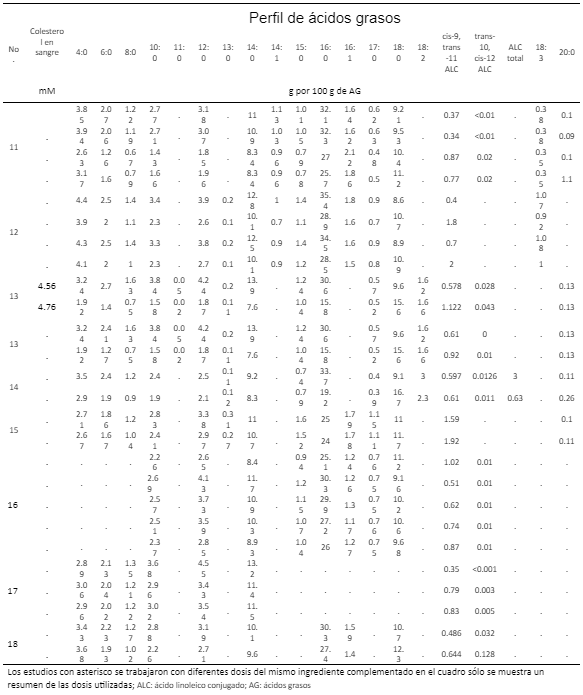
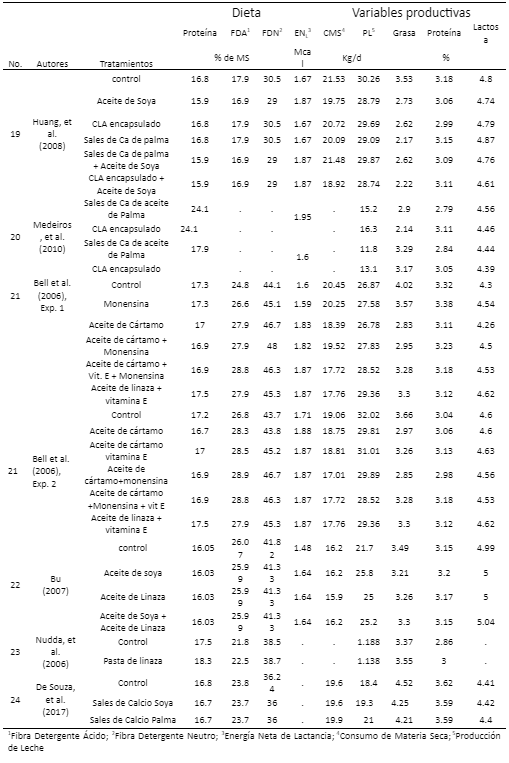
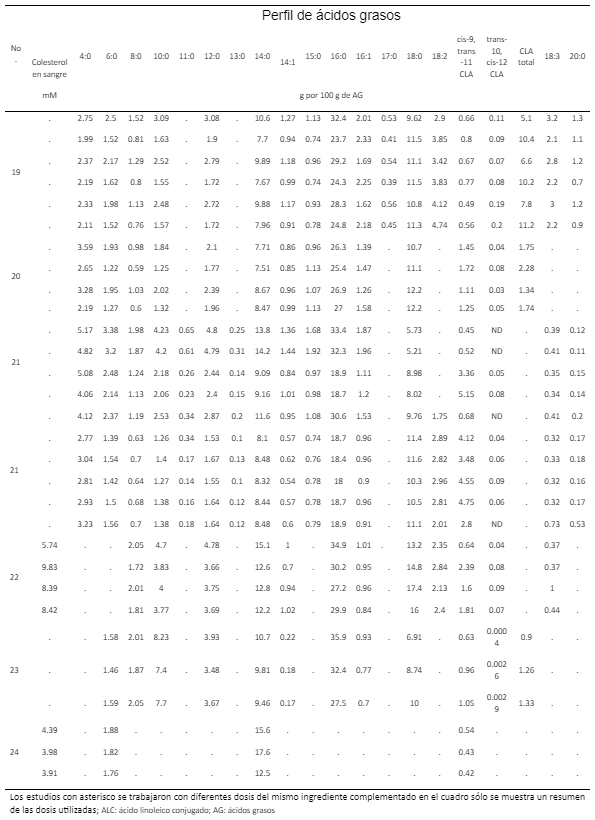
Resultados
Discusión
Conclusiones
1. Green PB, Turner L, Stevenson E, Rumbold PLS. Short communication: Patterns of dairy consumption in free-living children and adolescents. J Dairy Sci 2015;8:3701-3705, DOI: https://doi.org/10.3168/jds.2014-9161.
2. Ha YL, Grimm NK, Pariza MW. Anticarcinogens from fried ground beef: Heat-altered derivatives of linoleic acid. Carcinogenesis 1987;8:1881-1887, DOI: https://doi.org/ 10.1093/carcin/8.12.1881.
3. McCrorie TA, Keaveney EM, Wallace JMW, Binns N, Livingstone MBE. Human health effects of conjugated linoleic acid from milk and supplements. Nutr Res Rev 2011;24: 206-227, DOI: https://doi.org/10.1017/S095442241000114.
4. Carvalho CCR, Caramujo MJ. The various roles of fatty acids. Molecules 2018;23:2583. DOI: https://doi.org/10.3390/molecules23102583.
5. German JB, Dillard CJ. Composition, structure, and absorption of milk lipids: a source of energy, fat-soluble nutrients, and bioactive molecules. Crit Rev Food Sci Nutr 2006;(46): 57-92, DOI: https://doi.org/10.1080/10408690590957098.
6. Bernal-Santos G, Perfield WJI, Barbano DM, Bauman DE, Overton TR. Production responses of dairy cows to dietary supplementation with conjugated linoleic acid (CLA) during the transition period and early lactation. J Dairy Sci 2003; 86:3218-3228, DOI: https://doi.org/10.3168/jds.S0022-0302(03)73925-3.
7. Bauman DE, Grinari M. Nutritional regulation of milk fat. Annual Nutr Rev 2003;23: 203-227, DOI: https://doi.org/10.1146/annurev.nutr.23.011702.073408.
8. Rosqvist F, Bjermo H, Kullberg J, Johanson L, Michaelson K, Ahlstrom H, Lind L, Riserus U. Fatty acid composition in serum cholesterol esters and phospholipids is linked to visceral and subcutaneous adipose tissue content in elderly individual: a cross sectional study. Lipids Health Dis 2017;16:68, DOI: https://doi.org7/10.1186/s12944-017-0445-2.
9. Marques ES, Interlenghia GS, Leiteb TH, Cunha DB, Verly E Jr, Steffen CM, Azeredo CM. Primary care–based interventions for treatment of obesity: a systematic review Public Health 2021;195:65-69.
10. Schade SD, Lynda S, Philip E. Cholesterol Review: A metabolically important molecule. End Pract 2020; 26 (12): 1514-1523, DOI: https://doi.org/10.4158/EP-2020-0347.
11. O’Donnell-Megaro AM, Capper JL, Weiss WP, Bauman DE. Effect of linoleic acid dietary vitamin E supplementation on sustained conjugated linoleic acid production in milk fat from dairy cows. J Dairy Sci 2012; 95: 7299-7307. DOI: https://doi.org/10.3168/jds.2012-5802.
12. Aprianita A, Donkor ON, Moate JP, Williams ORS, Auldist MJ, Greenwood JS, Hannah MC, Wales WJ, Vasiljevic T. Effects of dietary cottonseed oil and tannin supplements on protein and fatty acid composition of bovine milk. J Dairy Res 2014; 81:183-192, DOI: https://doi.org /10.1017/S0022029914000065.
13. Ferlay A, Doreau M, Martin C, Chilliard Y. Effects of incremental amounts of extruded linseed on the milk fatty acid composition of dairy cows receiving hay or corn silage. J Dairy Sci 2013; 96: 6577-6595, DOI: https://doi.org/10.3168/jds.2013-6562.
14. Kliem KE, Shingfield KJ, Humphries DJ, Givens DI. Effect of replacing calcium salts of palm oil distillate with incremental amounts of conventional or high oleic acid milled rapeseed on milk fatty acid composition in cows fed maize silage-based diets. Animal 2011; 5(8): 1311-1321, DOI: https://doi.org/10.1017/S1751731111000310.
15. Hutchinson IA, Hennessy AA, Dewhurts RJ, Evans ACO, Lonergan P, Butler ST. The effect of strategic supplementation with trans-10, cis-12 conjugated linoleic acid on the milk production, estrous cycle characteristics, and reproductive performance of lactating dairy cattle. J Dairy Sci 2012;95: 2442-2451, DOI: https://doi.org /10.3168/jds.2011-4632.
16. Vahmani P, Fredeen AH, Glover KE. Effect of supplementation with fish oil or microalgae on fatty acid composition of milk from cows managed in confinement or pasture systems. J Dairy Sci 2013;96: 6660-6670, DOI: https://doi.org/ 10.3168/jds.2013-6914.
17. Boerman JP, Lock AL. Effect of unsatured fatty acids and triglycerides from soybeans on milk fat synthesis and biohydrogenation intermediates in dairy cattle. J Dairy Sci 2014;97: 7031-7042, DOI: https://doi.org/10.3168/jds.2014-7966.
18. Giesy JG, McGuire MA, Shafii B, Hanson TW. Effect of dose of calcium salts of conjugated linoleic acid (CLA) on percentage and fatty acid content of milk fat in Midlactation Holstein Cows. J Dairy Sci 2002;85: 2023-2029. DOI: https://doi.org/10.3168/jds. S0022-0302(02)74279-3.
19. Huang Y, Schoonmaker JP, Bradford BJ, Beitz DC. Response of milk fatty acid composition to dietary supplementation of soy oil, conjugated linoleic acid or both. J Dairy Sci 2008;91: 260-270, DOI: https://doi.org/10.3168/jds.2007-0344.
20. Medeiros SR, Oliveira DE, Aroeira LJM, McGuire MA, Bauman DE, Lanna DPD. Effects of dietary supplementation of rumen protected conjugated linoleic acid to grazing cows in early lactation. J Dairy Sci 2010; 93: 1126-1137, DOI: https://doi.org/10.3168/jds.2009-2645.
21. Bell JA, Griinari JM, Kennelly JJ. Effect of safflower oil, flaxseed oil, Monensin, and vitamin E on concentration of conjugated linoleic acid in bovine milk fat. J Dairy Sci 2006;89: 733-748, DOI: https://doi.org/10.3168/jds.S0022-0302(06)72135-X.
22. Bu DP, Wang JQ, Dhiman TR, Liu SJ. Effectiveness of oils rich in linoleic and linoleic acids to enhance conjugated linoleic acid in milk from dairy cows. J Dairy Sci 2007; 90: 998-1007, DOI: https://doi.org/10.3168/jds.S0022-0302(07)71585-0.
23. Nudda A, Battacone G, Usai MG, Fancellu S, Pulina G. Supplementation with Extruded linseed cake affects concentrations of conjugated linoleic acid and vaccenic acid in goat milk. J Dairy Sci 2006 89:277-282, DOI: https://doi.org/ 10.3168/jds.S0022-0302(06)72092-6.
24. de Souza J, Batistel F, Portela SFA. Effect of sources of calcium salts of fatty acids on production, nutrient digestibility, energy balance and carryover effects of early lactation grazing dairy cows. J Dairy Sci 2017; (100): 1072-1085. DOI: https://doi.org/10.3168/jds.2016-11636.
25. Gonthier C, Mustafa AF, Ouellet DR, Chouinard PY, Berthiaume R, Petit HV. Feeding micronized and extruded flaxseed to dairy cows: Effects on Blood parameters and milk fatty acid composition. J Dairy Sci 2005;88: 748-756. DOI: https://doi.org/10.3168/jds. S0022-0302(05)72738-7.
26. Sippel MA, Spratt RS, Cant JP. Milk production responses of primiparous and multiparous dairy cows to dose of conjugated linoleic acid consumed in rumen inert form. Can J Animal Sci. 2009;393-399, DOI: https://doi.org /10.4141/CJAS08104.
27. Bayat AR, Tapio I, Vilkki J, Shingfield KJ, Leskinen H. Plant oil supplements reduce methane emissions and improve milk fatty acid composition in dairy cows fed grass silage-based diets without affecting milk yield. J Dairy Sci 2018; 101:11366-1151, DOI: https://doi.org/10.3168/jds.2017-13545.
28. Juchem SO, Santos JEP, Cerri RLA, Chebel RC, Galvao KN, Bruno R, De Peters JE, Scott T, Thatcher WW, Luchini D. Effect of calcium salts of fish and palm oils on lactational performance of Holstein cows. J Animal Feed Sci Tech 2008; 140: 18-38, DOI: https://doi.org/ 10.1016/j.anifeedsci.2007.01.018.
29. Loor JJ, Ferlay A, Olier A, Doreau M, Chilliard Y. Relationship among trans and conjugated fatty acids and bovine milk fat yield due to dietary concentrate and linseed oil. J Dairy Sci. 2005; 88: 726-740. DOI: https://doi.org/10.3168/jds. S0022-0302(05)72736-3.
30. Alstrup L, Soegaard K, Weisberg RM. Effects of maturity and harvest season of grass-clover silage and of forage-to-concentrate ratio on milk production of dairy cows. J Dairy Sci. 2016;99: 328-340, DOI: https://doi.org/10.3168/jds.2015-9802.
31. Rezaei RA, Towhidi A, Zhandi M, Rezayazdi K, Rahini GM, Dirandeh E, Colazo MG. Effect of conjugated linoleic acid supplementation during the transition period on plasma metabolites and productive and reproductive performances in dairy cows. J Animal Feed Sci Tech 2016;(219): 294-303, DOI: https://doi.org/ 10.1016/janifeedsci.2016.07.004.
32. Moreira, S. E.D. Produtividade e Valor nutritivo de Urochloa brizantha cv. Piatã e Qualidade do Solo em Sistemas Silvipastoris na Região Central de Minas Gerais. Thesis of Doutorado. Universidade Federal de Minas Gerais. Ecola de Veterinária. Minas Gerais, Brasil.
33. Bauman DE, Chouinard PY, Lebeuf Y, Rico DE, Gervais R. Effect of lipid supplementation on milk odd-and branched-chain fatty acids in dairy cows. J Dairy Sci 2016; 99: 1-13, DOI: https://doi.org/10.3168/jds.2015-10746.
34. Piantoni P, Lock AL, Allen AS. Palmitic acid increased yields of milk and milk fat and nutrient digestibility across production level of lactating cows. J Dairy Sci 2013;96: 7143-715, DOI: https://doi.org/10.3168/jds.2013-6680.
35. SAS. SAS User’s Guide: Statistics (Version 9.1.3). SAS Inst. Inc. Cary, NC, USA; 2012.
36. Sterk A, Vlaeminck B, van Vuuren AM, Hendriks WH, Dijkstra J. Effects of feeding different linseed sources on omasal fatty acid flows and fatty acid profiles of plasma and milk fat in lactating dairy cows. J Dairy Sci. 2012. 95:3149–3165.
37. Zinn RA, Salinas J. Influence of fibrozyme on digestive function and growth performance of feedlot steers fed a 78% concentrate growing diet. In Proc Nottingham University Press, Loughborough, UK 1999; 313-319.
38. Feng P, Hunt CW, Pritchard GT, Julien WE. Effect of enzyme preparations on in situ and in vitro degradation and in vivo digestive characteristics of mature cool-season grass forage in beef steers. J Animal Sci 1996;74: 1349-1357. DOI: https://doi.org/10.2527/1196.7461349x.
39. Castro T, Martinez D, Isabel B, Cabezas A, Jimeno V. Vegetable oils rich in polyunsaturated fatty acids supplementation of dairy cows’ diets: effects on productive and reproductive performance. Animal 2019; 9 (5): 205, DOI: https://doi.org/10.3390/ani9050205.
40. dos Santos Neto JM, de Souza J, Lock A. L. Effects of calcium salts of palm fatty acids on nutrient digestibility and production responses of lactating dairy cows: A meta-analysis and meta-regression. J Dairy Sci 2021. (104): 9752–9768, DOI: https://doi.org /10.3168/jds.2020-19936.
41. NRC. National Research Council. 2001. Nutrient Requirements of Dairy Cattle: Seventh Revised Edition. Washington, DC: The National Academies Press, DOI: https://doi.org/ 10.17226/9825.
42. Rabiee AR, Breinhild K, Scott W, Golder HM, Block E, Lean IJ. Effect of fat additions to diets of dairy cattle on milk production and components: A meta-analysis and meta-regression. J Dairy Sci 2012;95(6): 3225-3247. DOI: https://doi.org /10.3168/jds.2011-4895.
43. Weiss WP, Pinos-Rodriguez JM. Production responses of dairy cows when fed supplemental fat in low-and high-forage diets. J Dairy Sci 2009; (92): 6144-6155. DOI: https://doi.org/10.3168/jds.2009-2558.
44. Kairenius P, Toivonen V, Shingfield KJ. Identification and Ruminal Outflow of long-chain fatty acid Biohydrogenation intermediates in cows fed diets containing fish oil. Lipids 2011;46(7): 587-606, DOI: https://doi.org/10.1007/s11745-011-3561-1.
45. Bauman DE, Grinari M. Nutritional regulation of milk fat. Annual Nutr Rev 2003;(23): 203-227, doi: 10.1146/annurev.nutr.23.011702.073408.
46. Ungerfeld EM, Urrutia NL, Vásconez-Motúfar C, Morales R. Factors associated with the content of mammary-synthesized fatty acids in milk fat: A meta-analysis. J Dairy Sci 2019; 102(5): 4105-4117, DOI: https://doi.org/10.3168/jds.2018-15157.
47. Freeman CP. Properties of fatty acids in dispersions of emulsified lipid and bile salt and the significance of these properties in fat absorption in the pig and the sheep. Brit J Nut 1969; 23: 249-259, DOI: https://doi.org/10.1079/bjn19690032.
48. de Souza J, St-Pierre RN, Lock AL. Altering the ratio of dietary C16:0 and cis-9 C18:1 interacts with production level in dairy cows: Effects on production responses and energy partitioning. J Dairy Sci 2019;102:9842–9856, DOI: https://doi.org/10.3168/jds.2019 -16374.
49. Palqmist DL, Harvatine KJ. Origin of fatty acids and influence of nutritional factors on milk fat. In: McSweeney P.L.H., Fox P.F., O'Mahony J.A. Advances Dairy Chemistry (eds) 2020;(2): 33-66, DOI: https://doi.org/10.1007/978-3-030-48686-0_2.
50. Brzozowska AM, Oprzadek J. Metabolism of fatty acids in tissues and organs of the ruminants – a review. J Animal Sci Rev 2016;34(3): 211-219.
51. Loor JJ, Herbein JH. Reduced Fatty Acid Synthesis and Desaturation Due to Exogenous trans10, cis12-CLA in Cows Fed Oleic or Linoleic Oil. J Dairy Sci 2003. 86(4):354-1369, DOI: https://doi.org/10.3168/jds.S0022-0302(03)73720-5.
52. Sung-Tae Y, Kreutzberger AJB, Lee J, Kiessling V, Tamm LK. The role of cholesterol in membrane fusion. Chem Physics Lipids 2016;(199):136-143, DOI: https://doi.org/10.1016/j.chemphyslip.2016.05.003.
53. Maxfield F, Tabas I. Role of cholesterol and lipid organization in disease. Nature 2005; 438: 612-621, DOI: https://doi.org/10.1038/nature04399.
54. Vargas-Bello-Perez E, Cancino-Padilla N, Geldsetzer-Mendoza C, Vyhmeister S, Morales, MS, Leskinen H., et al. 2019. Effect of feeding cows with unsaturated fatty acid sources on milk production, milk composition, milk fatty acid profile, and physicochemical and sensory characteristics of ice cream. Animal. 9:568. DOI: https://doi.org/ 10.3390/ani9080568.
55. Chung-Chia L, Ting-Tsz O, Hui-Pei H, Chau-Jong W. The inhibition of oleic acid induced hepatic lipogenesis and the promotion of lipolysis by caffeic acid via up regulation of AMP-activated kinase. J Sci Food Agric. 2013;94(6): 11541162, DOI: https://doi.org/10.1002/jsfa.6386.
56. Kabir M, Skurnik G, Naour N, Pechtner V, Meugnier E, Rome S, Quignard-Boulangé A, Vidal H, Slama G, Clément K, Guerre-Millo M, Rizkalla SW. Treatment for 2 with n-3 polyunsaturated fatty acids reduces adiposity and some atherogenic factors but does not improve insulin sensitivity in women with type 2 diabetes: a randomized controlled study. Amer J Clin Nutr. 2007;86(6): 1670-1679, DOI: https://doi.org/10.1093/ajcn/86.6.1670.
57. Botham K, Zheng X, Napolitano M, Avella M, Cavallari C, Rivabene R, Bravo E. The effects of dietary n-3 Polyunsaturated fatty acids delivered in chylomicron remnants on the transcription of genes regulating synthesis and secretion of very low-density lipoprotein by the liver: Modulation by cellular oxidative state. Exp Biology Med 2003;228(2): 143-1, DOI: https://doi.org/10.1177/153537020322800203.
58. Edem DO. Palm oil: Biochemical, physiological, nutritional, hematological, and toxicological aspects: a review. Plant Foods Human Nutr. 2002;57: 319-341 DOI: https://doi.org/10.1023/A:1021828132707.
59. Sundram K, French AM, Clandinin MT. Exchanging partially hydrogenated fat for palmitic acid in the diet increases LDL-cholesterol and endogenous cholesterol synthesis in normocholesterolemic women. European J Nutr. 2003;(42): 188-194. DOI: https://doi.org/10.1007/s00394-003-0411-9.
60. Brouwer AI. Effects of trans-fatty acid intake on blood lipids and lipoproteins: a systematic review and meta-regression analysis. WHO Library Cataloguing-in-Publication. World Health Organization. 2016.
61. Shidfar F, Keshavarz A, Hosseyni S, Ameri A, Yarahmadi S. Effects of Omega-3 supplements on serum lipids, apolipoproteins and malondialdehyde in type 2 diabetes patients. East Mediterr Health J 2008;14(2): 305-313.
















