INTRODUCCIÓN
Biogeográficamente, los ecosistemas altoandinos constituyen grandes unidades de cobertura vegetal, con formaciones herbáceas típicas. Estos ecosistemas se ubican en el contexto de la Cordillera de los Andes, entre 3800 y 4800 m sobre el nivel del mar y ocupan una superficie de 18 millones de hectáreas, que representa el 14% del territorio nacional (MINAM, 2015), donde se concentra gran parte de la actividad ganadera extensiva del país, con predominio de pastos naturales de tipo pajonal y césped de puna, entre los que destacan las poaceas.
Los pastizales naturales altoandinos desempeñan un papel importante en el mantenimiento y funcionalidad de los ecosistemas, así como en la economía y seguridad alimentaria (Flores, 2016). Además, contribuyen en la captura y almacenamiento de carbono orgánico en el suelo y biomasa (Calderón-Loor et al., 2020; Huamán-Carrión et al., 2021). Estos pastizales proveen forraje al 80% de la ganadería nacional; sin embargo, son de baja productividad (Oliveras et al., 2014) y calidad nutricional (Flores, 2016; Castellaro et al., 2020), como consecuencia de la degradación ecológica (Xie y Sha, 2012; Heitkamp et al., 2014; Sylvester et al., 2017; Wambui et al., 2021).
Entre las especies persistentes a la degradación de los pastizales en el pajonal de puna y de amplia distribución, se encuentran las especies perennes: Calamagrostis vicunarum, una cespitosa con cañas de 5- 25 cm de altura; Festuca dolichophylla, una planta amacollada con cañas de 50-70 cm de altura y Muhlenbergia ligularis, cespitosa con cañas decumbentes o postradas de 4-8 cm de largo (Tovar, 1993) y que a menudo se utilizan para la recuperación de pastos degradados y prevenir la erosión del suelo. Si bien algunas especies presentan cierta rusticidad que les permite crecer en las duras condiciones climáticas y la baja fertilidad del suelo de la puna, su desempeño puede ser limitado, con disminución del crecimiento vegetativo, rendimiento de forraje y contenido de nutrientes (Crespo et al., 2015). Esta situación compromete a la ciencia a desarrollar estrategias para recuperar e incluso incrementar la productividad de los pastizales mediante alternativas como el uso de bacterias endófitas promotoras de la absorción de nutrientes (BEPAN).
Las plantas no son organismos que viven aisladas de otras formas de vida, pues ahora se conoce que tienen relaciones mutualistas o simbióticas con otros organismos como los hongos o las bacterias que les permiten optimizar su desempeño en condiciones desfavorables (García-Latorre et al., 2021). Para ello, las plantas recurren a su capacidad fisiológica de absorción de iones mediante respuestas plásticas del sistema radicular a través del cual se hace posible la activación de las diferentes formas de abastecimiento de nutrientes disponibles en el suelo (Hodge, 2004).
El uso de bacterias endófitas para mejorar la absorción de nutrientes en diferentes plantas está ampliamente documentado (Sá et al., 2019; White et al., 2019; Ochoa-Hueso et al., 2020). Dentro de las bacterias endófitas, Lopes et al. (2018) indican que especies de Bacillus endofíticas son promotoras del crecimiento de plantas mediante el suministro de nutrientes y la regulación del transporte de agua; asimismo, indican que son una fuente subexplotada de moléculas novedosas de interés biotecnológico. Belincanta et al. (2021) señalan también las bondades del uso de bacterias endófitas en especies como Dendrocalamus asper y Bambusa oldhamii. Las bacterias endofítas son capaces de mejorar la absorción de nutrientes de las plantas a través de la solubilización de fosfato, la fijación de nitrógeno, la producción de ácido indol-3-acético (IAA), el transporte de hierro (sideróforo), desaminasa del ácido 1-aminociclopropano1-carboxílico (ACC) y enzimas hidrolizantes (Hassan, 2017; Ochoa-Hueso et al., 2020; Hazarika et al., 2021). El efecto de bacterias en el contenido de nutrientes en plantas ha sido reportado también por autores como Kumar et al. (2014), Hungria et al. (2021) y Verma et al. (2021).
La eficacia de la interacción entre las poaceas y las bacterias promotoras de la absorción de nutrientes (BEPAN) puede convertirse en una alternativa importante para incrementar la productividad de los pastizales naturales. Sin embargo, el efecto de una bacteria endófita en una planta huésped en particular puede ser variable (Bastias et al., 2021), dependiendo de la especie endofítica, el genotipo del huésped y las condiciones ambientales (Ahlholm et al., 2002). Además, en un escenario de cambio climático, donde se espera una disminución de las precipitaciones en las zonas de mayor vulnerabilidad (Bilal et al., 2018), el uso de estos endófitos o sus metabolitos podría contribuir a mitigar sus efectos, manteniendo niveles considerables de la producción de forraje para la fauna doméstica y silvestre, a la vez que se podría reducir el uso de fertilizantes químicos sintéticos.
En la presente investigación se planteó la hipótesis de que la inoculación de pastizales naturales con bacterias endófitas nativas mejora el contenido de macro y micronutrientes en la biomasa aérea de Calamagrostis vicunarum, Festuca dolichophylla y Muhlenbergia ligularis. De esta manera, el objetivo del estudio fue determinar la contribución de bacterias endófitas en la acumulación de nutrientes en tres poaceas altoandinas.
MATERIALES Y MÉTODOS
El estudio se realizó en la comunidad de Ccarhuaccpampa, distrito de Paras, provincia de Huamanga, departamento de Ayacucho, Perú, ubicada a una altitud de 4116 m. La temperatura media mensual fue de 3.4 a 8.6 ºC y las precipitaciones mensuales variaron desde 31 a 235 mm durante el experimento. Los suelos de la zona son franco-arcilloso-arenosos, con pH ácido (5.35), alto contenido de materia orgánica (6%) y nitrógeno total (0.32%), contenido medio de fósforo disponible de 17 ppm y contenido bajo de potasio (88 ppm).
Se evaluaron 19 bacterias endófitas aisladas de pastizales de la comunidad de Ccarhuaccpampa-Ayacucho. Las bacterias fueron reactivadas en agar nutritivo, y multiplicadas en caldo nutritivo a 28 °C durante 48 h. Al término de este tiempo presentaron concentraciones comprendidas entre 1 a 2 x 109 UFC/ml (unidades formadoras de colonias). Cada una de las bacterias multiplicadas fue mezclada con turba molida esterilizada, e incubada a 25 °C durante 48 h. Los inóculos obtenidos presentaron concentraciones superiores a 1 x 108 UFC/g de turba.
Los pastizales fueron clausurados y tuvieron un área experimental de 10 000 m2 , en los que se distribuyeron los 22 tratamientos (19 bacterias individuales más tres controles) (Cuadro 1), utilizando el diseño Bloques completos al azar con tres repeticiones. Cada unidad experimental tuvo un área de 75 m2 . La selección de los pastizales se realizó considerando la predominancia de las especies de interés.
Las áreas seleccionadas para la aplicación de las bacterias recibieron previamente un abonamiento básico, similar al control 1 (Cuadro 1). Las bacterias fueron aplicadas al voleo en forma de inoculante a razón de 3 kg/ha. Luego de cuatro meses de la aplicación de las bacterias se realizó el corte, al ras del suelo, de las tres poaceas seleccionadas (Calamagrostis vicunarum, Festuca dolichophylla y Muhlenbergia ligularis) utilizando tijeras y considerando 12 plantas por especie. Las muestras de cada especie de poacea fueron enviadas al laboratorio CERPER S.A. (Perú), para el análisis de macro (N, P, K, Ca, Mg, S, Cl y Na) y micronutrientes (B, Cu, Fe, Zn, Mn y Mo) de la biomasa aérea.
Los resultados fueron evaluados mediante el análisis multivariante de datos y de componentes principales (ACP), análisis de conglomerados y correlaciones con el programa estadístico RStudio y MultBiplot Win64 (Villardón, 2015). Asimismo, se determinaron los porcentajes de incremento por efecto de las bacterias en cada uno de los nutrientes y poaceas.
RESULTADOS
Contribución de las bacterias endófitas en la acumulación de nutrientes de poaceas
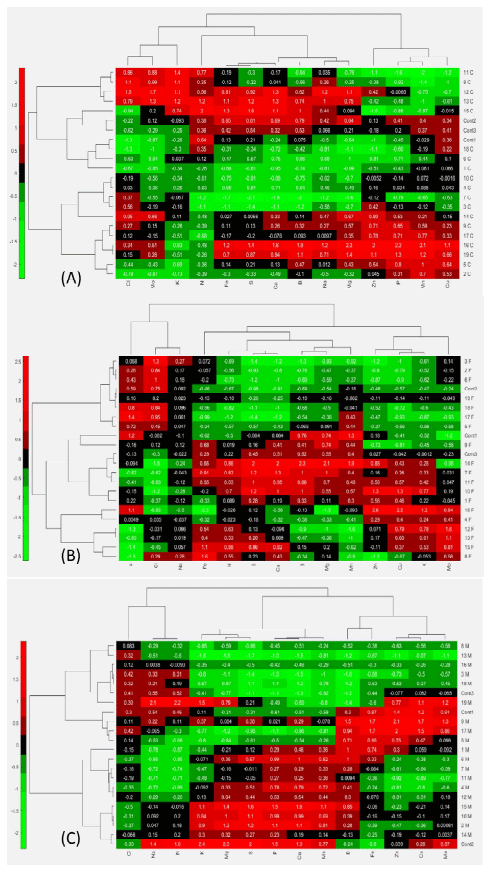
En Calamagrostis vicunarum, el análisis de componentes principales (ACP) (Figura 1A), demostró el agrupamiento (cluster) de las bacterias en tres grupos, con base a similitudes de las bacterias en la acumulación de nutrientes. El grupo 1, conformado por las bacterias 11, 6, 18, 15 y los controles 1 y 3, se relacionó con los macronutrientes K, N y Cl. El grupo 2, constituido por las bacterias 16, 19, 9, 14, 12, 13, 8 y control 2, se relacionaron con los macronutrientes N, Cl, Ca, S, Na y Mg y con los micronutrientes Mo, Fe y B. El grupo 3, conformado por las bacterias 7, 1, 3, 10, 4, 2, 17 y 5, no se relacionó con nutriente alguno. Estos resultados indicaron un comportamiento diferenciado de las bacterias, destacando las integrantes del grupo 2 por relacionarse con el mayor número de nutrientes.
El análisis de componentes principales (ACP) en Festuca dolichophylla (Figura 1B) también reportó el agrupamiento (cluster) de las bacterias en tres grupos. El grupo 1, constituido por las bacterias 14, 10, 7, 11, 3, 1, 15, 8, 13, 12 y el control 3, se relacionaron con los macronutrientes K, N, S y Ca y con los micronutrientes Mo, Fe, Cu y Zn. El grupo 2, conformado por las bacterias 5, 9 y control 1, no se relacionaron con nutriente alguno; en tanto que el grupo 3, conformado por las bacterias 3, 17, 6, 18, 2, 19, 4, 16 y el control 2, se relacionó con los macronutrientes Cl y Na. El comportamiento de las bacterias en esta especie fue igualmente diferente, destacando los integrantes del grupo 1 por relacionarse con el mayor número de nutrientes.
Cuadro 1. Bacterias endófitas en estudio y controles
En el caso de Muhlenbergia ligularis, el ACP (Figura 1C) se estableció tres grupos (cluster). El primero constituido por las bacterias 11, 4, 6, 7, 12, 1 y 5 y el segundo por las bacterias 13, 3, 8 y 18 y el control 3, donde estos dos grupos no se relacionaron con nutriente alguno. El grupo 3 constituido por las bacterias 15, 2, 10, 14, 9, 19, 17 y los controles 1 y 2, se relacionaron con los macronutrientes S, Mg, K, N, Na y los micronutrientes B, Mo, Zn, Cu y Fe. En esta especie, por lo tanto, destacó el grupo 3.
La matriz de correlaciones en Calamagrostis vicunarum (Figura 2A) presentó similar tendencia de agrupamiento obtenidos en el ACP; sin embargo, considerando los valores mayores de uno (> 1) de la escala MultBiplot de aporte a la acumulación de nutrientes, destacó la bacteria 16, que aportó a la acumulación de los macronutrientes de S, Ca, Na, Mg, P y de los micronutrientes Fe, B, Zn, Mn y Cu. Asimismo, la bacteria 12 contribuyó a la acumulación de K, Cl, Ca, Na y Mg (macronutrientes) y Mo (micronutrientes); la bacteria 13 a los macronutrientes K, N, S, Ca, Na y micronutrientes Fe y Mo; la bacteria 15 a los macronutrientes N, S y Ca y a los micronutrientes Fe y B y la bacteria 19 aportó a los macronutrientes Mg, P y a los micronutrientes B, Zn, y Mn. Los controles no aportaron a la acumulación de los nutrientes. En resumen, este grupo de bacterias (16, 12, 13, 15 y 19) estarían contribuyendo a la acumulación de los macronutrientes: S, Ca, Na, Mg, P, K, N, y de los micronutrientes: Fe, B, Zn, Mn, Cu y Mo.
Figura 1. Agrupamiento de bacterias y nutrientes mediante el análisis de componentes principales (ACP) en: Calamagrostis vicunarum (A), Festuca dolichophylla (B) y Muhlenbergia ligularis (C)
Figura 2. Matriz de correlación y escala MultBiplot de las bacterias y su contribución a la acumulación de nutrientes en Calamagrostis vicunarum (A), Festuca dolichophylla (B) y Muhlenbergia ligularis (C)
La matriz de correlaciones en Festuca dolichophylla (Figura 2B) presentó una similar tendencia de agrupamiento del ACP; sin embargo, considerando los valores mayores de uno (> 1) de la escala MultBiplot de aporte a la acumulación de nutrientes, destacaron las bacterias 14 que contribuyó a la acumulación de los macronutrientes de S, Ca y Mg y de los micronutrientes B y Mn; la bacteria 7 a la acumulación de S, Ca y Mg y del micronutriente B; la bacteria 10, a la acumulación de S y Ca (macronutrientes) y B, Zn y Cu (micronutrientes); y la bacteria 16, a los macronutrientes P y K, y micronutrientes Zn y Cu. Por otro lado, el control 1 aportó a la acumulación de P y Mn, mientras que el resto de los controles no aportaron a la acumulación de nutrientes. En resumen, este grupo de bacterias (14, 7, 10, 16) estaría contribuyendo a la acumulación de los macronutrientes: S, Ca, Mg, P y K y de los micronutrientes: B, Zn, Mn y Cu.
La matriz de correlaciones en Muhlenbergia ligularis (Figura 2C), presentó similar tendencia de agrupamiento del ACP, y considerando los valores mayores de uno (> 1) de la escala MultBiplot de aporte a la acumulación de nutrientes, destacaron las bacterias 19 que aportó a la acumulación de los macronutrientes de Na, N y K y de los micronutrientes Cu y Mo; la bacteria 9 contribuyó a la acumulación de los micronutriente B, Fe, Zn, Cu, Mo; la bacteria15 que aportó a la acumulación de K, Mg, S, P y Ca (macronutrientes) y Mn (micronutrientes); la bacteria 2 a los macronutrientes Mg, S, P y Ca, y la bacteria 17 a los micronutrientes Fe, Zn y Cu. Asimismo, el control 1 aportó a la acumulación de los micronutrientes Zn y Cu, el control 2 a la acumulación de los macronutrientes Na, N, K, Mg, S, P y Ca; en tanto que el aporte del control 3 fue nulo. En resumen, este grupo de bacterias (19, 9, 15, 2, 17) estaría aportando a la acumulación de los macronutrientes: Na, N, K, Mg, S, P y Ca y micronutrientes: Cu, Mo, B, Fe, Zn y Mn.
Incremento en el contenido de nutrientes en la biomasa aérea de tres especies de poaceas
Los porcentajes de incremento en el contenido de macro y micronutrientes por efecto de las bacterias en la biomasa aérea de las tres poaceas fueron dependientes de la especie de la planta y del tipo de bacteria.
En Calamagrostis vicunarum (Figura 3A), las bacterias incrementaron entre 4 a 67% los contenidos de todos los nutrientes, destacando el K (67%), Mn (57%), Na (50%), Mo (48%), Cl (35%) y Ca (25%), mientras que el incremento de los demás nutrientes fue entre 4 a 17%. En la Figura 3B se verifica que las bacterias 16, 12, 19, 13, 5, 9, 14, 17 y 8 contribuyeron en el incremento del contenido de nutrientes con porcentajes entre 3.36 a 35.64%, destacando las bacterias 16, 12, 19 y 13 que contribuyeron con 35.64, 23.93, 18.50 y 15.21%, respectivamente.
Los incrementos en Festuca dolichophylla (Figura 3C) fueron entre 10 a 100%, destacando los nutrientes Na (100%), Mo (87%), Cl (39%), Zn (28%), K (27%), P (26%), Mn (23%) y Fe (20%), mientras que en el resto de los nutrientes fue entre 10 a 17%. Asimismo, en F. dolichophylla se verificó que las bacterias contribuyeron en el incremento de nutrientes mencionados en 2.25 a 25.89% (Figura 3D) destacando las bacterias 7 (25.89%), 11 (22.07%), 12 (14.75), 10 (13.25), 4 (11.93%), y 14 (11.82%), en tanto que el resto de las bacterias incrementaron entre 2.25 a 9.82%.
Figura 3. Incremento y contribución de bacterias en la acumulación de nutrientes en Calamagrostis vicunarum (A, B), Festuca dolichophylla (C, D) y Muhlenbergia ligularis (E, F)
Las bacterias incrementaron los contenidos de todos los nutrientes en Muhlenbergia ligularis (Figura 3E), excepto Na, entre 3.5 a 147%, destacando los incrementos de Fe (147%), Mo (127%), B (57%) P (50%), Zn (33%), S (28%), y Mn (26%). El resto de los nutrientes (Mg, Ca, Cu, K, Cl y N) fueron incrementados entre 3.5 a 19.6%. En esta especie se verificó que las bacterias 9, 17, 5, 15, 10, 1, 19, 6, 12, 14 contribuyeron en la acumulación de nutrientes con porcentajes de 73.57, 33.29, 31.64, 28.79, 26.29, 21.14, 19.57, 19.50, 17.14, y 15.64% respectivamente (Figura 3F).
DISCUSIÓN
Los resultados obtenidos han demostrado la contribución de las bacterias endófitas en la acumulación de nutrientes en las Poaceas evaluadas, superando en la mayoría de los casos a los controles.
El incremento de los macronutrientes por influencia de los microorganismos ha sido reportado por varios autores. Hungria et al. (2021), al trabajar con Urochloa (Brachiaria) spp, encontraron un incremento del contenido de N entre 11.7 y 20.7% y de K entre 9.9 y 11.3% al inocular Azospirillum brasilense, y de 33.3 y 36.6% para P, de 10.6 y 13.6% para K con Pseudomonas fluorescens, aunque estos incrementos fueron inferiores a los observados en la presente investigación. Asimismo, García-Latorre et al. (2021) informan sobre incrementos en los contenidos de Na y S (10.34 y 14.29%, respectivamente) en Trifolium subterraneum y Poa pratensis inoculadas con el endófito E408; en tanto que Cipriano et al. (2021) obtuvieron incrementos de N (4%), P (12.6%), K (11.5%), Ca (6%), Mg (6.6%) y S (12.3%) en caña de azúcar, que también es una poacea, inoculada con bacterias endófitas, siendo estos incrementos inferiores a los encontrados en el presente estudio.
El incremento de los micronutrientes por influencia de los microorganismos también ha sido reportado por varios autores. Por ejemplo, García-Latorre et al. (2021) inocularon Trifolium subterraneum y Poa pratensis con diferentes endófitosaumentando la absorción de B, Cu y Zn en proporciones semejantes a las del presente estudio. Asimismo, Cipriano et al. (2021) informan incrementos de Mn, Cu, Zn, B y Fen caña de azúcar inoculada con bacterias endófitas frente al control sin inocular, con valores igualmente similares a los de este trabajo, con excepción del B. Del mismo modo, Kumar et al. (2014) indicaron sobre el efecto de Bacillus megaterium, Arthrobacter chlorophenolicus y Enterobacter en granos de trigo, y Boleta et al. (2020) con inóculos de Azospirillum en cultivares de trigo presentaron valores similares o inferiores a los de la presente investigación, dependiendo del nutriente.
Referente a los porcentajes de incremento ejercidos por las bacterias, se observaron mayores porcentajes de incremento de K (67%), Ca (25%) y Mn (57%) en C. vicunarum, Na (100%) en F. dolichophylla y Fe (147%), Mo (127%), B (57%), P (50%), S (28%) en M. ligularis, lo cual demuestra la diversidad de respuesta de las especies a la inoculación con bacterias endófitas. Este comportamiento variado de las bacterias en las poaceas también ha sido observado por otros autores. Al respecto, Bastias et al. (2021) mencionan que el efecto de un endófito en una planta hospedante en particular puede variar dependiendo de la especie endofítica, el genotipo del hospedador y las condiciones ambientales. Asimismo, Afzal et al. (2019) manifiestan que la especie de la planta huésped determina el tipo de bacteria endofítica que la coloniza. Cipriano et al. (2021), por otro lado, informan sobre los variados comportamientos de bacterias endófitas en la acumulación de nutrientes (Paraburkholderia caribensis, Kosakonia radicincitans, Paraburkholderia tropica, Pseudomonas fluorescens, Herbaspirillum frisingense) inoculadas en caña de azúcar (Saccharum officinarum).
Es importante considerar la necesidad de reafirmar los resultados de la presente investigación porque en el suelo existen otros organismos (bacterias, hongos, protozoarios, etc.) y diferentes condiciones de suelo (ácidos húmicos, fúlvico, etc.) que también podrían haber contribuido en la absorción de estos nutrientes.
CONCLUSIONES
- Los resultados muestran la capacidad de las bacterias endófitas para acumular mayor porcentaje de nutrientes en la biomasa aérea de las poaceas altoandinas.
- Se evidencia una acción diferenciada de las bacterias endofitas según especie de poacea.
Agradecimientos
Los autores expresan su agradecimiento al Fondo de Desarrollo Socioeconómico de Camisea (FOCAM) de la Universidad Nacional de San Cristóbal de Huamanga por la subvención económica prestada para la ejecución de la presente investigación.
















