Determinación de la inmunidad pasiva del becerro recién nacido por el uso de calostro enriquecido con IgY
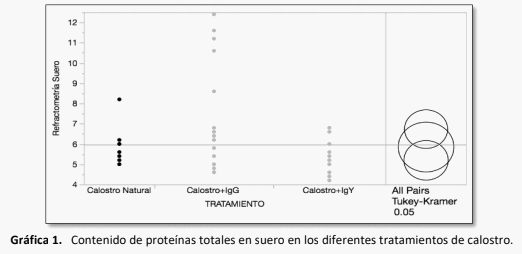
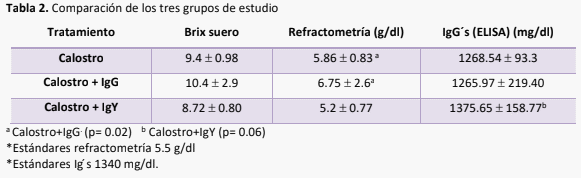
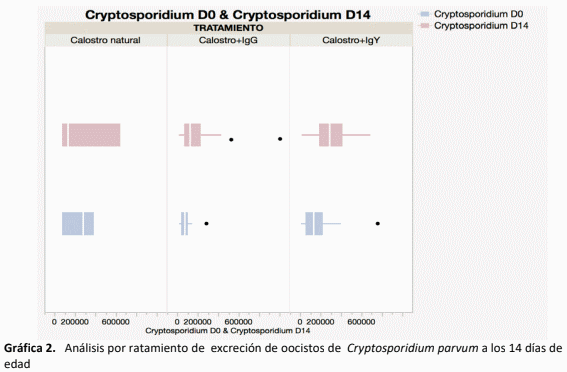
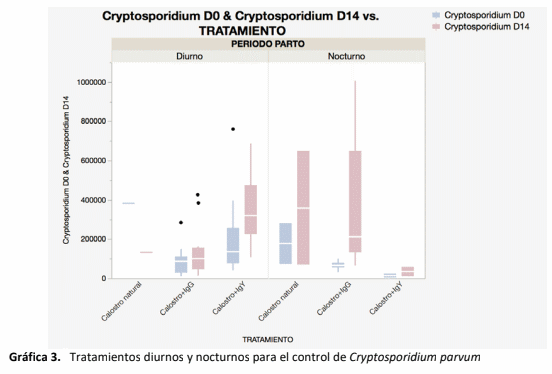
La inmunidad pasiva en el becerro recién nacido depende del calostro que ingiere en las primeras horas del nacimiento, la industria lechera está en constante búsqueda de formas complementarias y alternativas para proveer esta protección, dado que el becerro nace amaglobulinémico1 . Las IgY constituyen esta alternativa, dado que pueden desarrollarse específicamente contra los patógenos virales, bacterianos y parasitarios que afectan más comúnmente al becerro2. El objetivo de este proyecto fue comparar tres tipos de inmunidad pasiva para identificar si las IgY muestran interacción con la absorción de IgG para protección inmunológica en el recién nacido. El estudio incluyó 50 becerros desde el nacimiento, a los que se les administraron tres diferentes tratamientos en forma aleatoria: 1. Calostro; 2. y 3. Calostro + IgY . El calostro se cosechó por tres semanas, se mezcló, congelándose en bolsas de 2 L, para ser suministrado solo o enriquecido según el grupo de estudio. El suero sanguíneo de cada becerro, se colectó a las 24 h de vida, analizándose con ELISA para determinación de IgG. No se encontraron diferencias estadísticas en la absorción de IgG, aunque si se observaron diferencias en refractometría con mejor respuesta fueron para Calostro + IgG. Si bien no se midieron las IgY circulantes, no se identifica una competencia en la absorción de IgG. Ninguno de los tratamientos demostró un mejor control del parásito Cryptosporidium spp., en la época de mayor eliminación del parásito al ambiente a los 14 días de edad, en el caso de calostro se observaron 2,83 x 104 oocistos por ml, en los becerros con calostro + IgG: 2,5 x 104 oocistos por ml y para los becerros con calostro + IgY: 3,07 x 104 oocistos por ml.
inmunidad, es mediante la inmunización de gallinas con patógenos, respondiendo con la producción de antígenos específicos para el patógeno con el que fueron infectadas (Carlander, 2000). El aislamiento de las IgY es muy simple y se pueden obtener hasta 25mg de IgY por yema de huevo, siendo del 2-10% antígenos específicos contra los patógenos por medio de hiper-inmunización de las aves. Existen diferencias entre las IgY aviares y las IgG de los mamíferos: las IgY no se enlazan con proteínas A o G, las inmunoglobulinas no interfieren con las IgG en pruebas serológicas y no activan el complemento mamífero (Vega el al., 2011). Según los experimentos dirigidos por Vega et al. en el caso de Rotavirus y, Lee et al. en el caso de Salmonella; la IgY es determinante para disminuir las incidencias de BVR y de Salmonella respetivamente, en becerros neonatos (Lee et al. 2002; Vega et al. 2011). Sin embargo, Pérez no encontró valores estadísticamente significativos, que demostraran que la IgY tuviera efectos positivos en la salud animal, ni en ningún parámetro zootécnico (peso y estatura a destete) (Pérez, 2015). Además, en bovinos ha sido demostrada su efectividad contra patógenos como rotavirus, coronavirus, E. coli enterotoxigénica (ETEC) y Salmonella spp y, en años recientes contra enfermedades causadas por protozoarios (Eimeria) presentándose así, como una alternativa prometedora contra C parvum. A pesar de lo anterior, aún no existen evidencias científicas concluyentes para su uso como una alternativa al tratamiento convencional (Diraviyam et al., 2014).
2. Se etiquetaron las muestras con número del becerro, grupo de tratamiento y fecha.
3. Las muestras fecales se mantuvieron en refrigeración a 4 oC hasta llevarlas al laboratorio de Diagnóstico Molecular, donde se almacenaron hasta su análisis
4. Se realizaron pruebas parasitológicas morfológicas y de cuantificación de los oocistos de Cryptosporidium parvum (Tabla 1).

1. Almawly, J., Prattley, D., French, N., Lopez- Villalobos, N., Hedgespeth, B., & Grinberg, A. (2013). Utility of halofuginone lactate for the prevention of natural cryptosporidiosis of calves, in the presence of co-infection with rotavirus and Salmonella typhimurium. Veterinary Parasitology, 197(1-2), 59-67. Baumrucker, C. R., Burkett, A. M., Magliaro-
2. Besser, T., Garmedia, A., McGuire, T. and Gay, C. (1985). Effect of Colostral Immunoglobulin G1 and Immunoglobulin M Concentrations on Immunoglobulin Absorption in Calves. Journal of Dairy Science, 68(8), pp.2033-2037.
3. Beam, A. L., Lombard, J. E., Kopral, C. A., Garber, L. P., Winter, A. L., Hicks, J. A., & Schlater, J. L. (2009). Prevalence of failure of passive transfer of immunity in newborn heifer calves and associated management practices on US dairy operations. Journal of dairy science, 92(8), 3973- 3980.
4. Butler, J. E. (1995). Antigen receptors, their immunomodulation and the immunoglobulin genes of cattle and swine. Livestock Production Science, 42(2-3), 105-121.
5. Carlander, D., Kollberg, H., Wejåker, P. E., & Larsson, A. (2000). Peroral immunotheraphy with yolk antibodies for the prevention and treatment of enteric infections. Immunologic research, 21(1), 1-6.
6. Cortese, V. S. (2009). Neonatal immunology. Veterinary Clinics: Food Animal Practice, 25(1), 221-227.
7. Chalghoumi, R., Beckers, Y., Portetelle, D., & Théwis, A. (2009). Biotechnologie, Agronomie, Société et Environnement, 13(2), 295.
8. Dairy Heifer Raiser (2011). An overview of operations that specialize in raising dairy heifers. USDA.
9. Diraviyam, T., Zhao, B., Wang, Y., Schade, R., Michael, A., & Zhang, X. (2014). Effect of Chicken Egg Yolk Antibodies (IgY) against Diarrhea in Domesticated Animals: A Systematic Review and Meta-Analysis. Plos ONE, 9(5), e97716.
10. Foster, D. M., & Smith, G. W. (2009). Pathophysiology of diarrhea in calves. Veterinary Clinics: Food Animal Practice, 25(1), 13-36.
11. Gold Standards (2016). Dairy Calf and Heifer Association.
12. Health Inspection Service, Veterinary Services. 1993. Transfer of maternal immunity to calves. Highlights of the National Dairy Heifer Evaluation Program. Bull. No. N118.0293. USDA.
13. Lee, E., Sunwoo, H., Menninen, K. and Sim, J. (2002). In vitro studies of chicken egg yolk antibody (IgY) against Salmonella enteritidis and Salmonella typhimurium. Poultry Science, 81(5), pp.632-641.
14. Quigley, J. 3., Kost, C. J., & Wolfe, T. M. (2002). Absorption of Protein and IgG in Calves Fed a Colostrum Supplement or Replacer1. Journal of dairy science, 85(5), 1243-1248.
15. Macrina, A. L., Dechow, C. D. (2010). Colostrogenesis: mass transfer of immunoglobulin G 1 into colostrum. Journal of dairy science, 93(7), 3031-3038.
16. Meganck, V., Hoflack, G., Piepers, S., & Opsomer, G. (2015). Evaluation of a protocol to reduce the incidence of neonatal calf diarrhoea on dairy herds. Preventive Veterinary Medicine, 118(1), 64-70.
17. Morin, D. E., Constable, P. D., Maunsell, F. P., & McCoy, G. C. (2001). Factors associated with colostral specific gravity in dairy cows. Journal of dairy science, 84(4), 937-943.
18. Parreño, V., Marcoppido, G., Vega, C., Garaicoechea, L., Rodriguez, D., Saif, L., & Fernández, F. (2010). Milk supplemented with immune colostrum: Protection against rotavirus diarrhea and modulatory effect on the systemic and mucosal antibody responses in calves experimentally challenged with bovine rotavirus. Veterinary immunology and
immunopathology, 136(1), 12-27.
19. Radostits, O. M., Gay, C. C., Hinchcliff, K. W., & Constable, P. D. (Eds.). (2006). Veterinary Medicine: A textbook of the diseases of cattle, horses, sheep, pigs and goats. Elsevier Health Sciences.
20. Rao, C. D., Gowda, K., & Reddy, B. Y. (2000). Sequence analysis of VP4 and VP7 genes of nontypeable strains identifies a new pair of outer capsid proteins representing novel P and G genotypes in bovine rotaviruses. Virology, 276(1), 104-113.
21. Tyler, J. W., Hancock, D. D., Thorne, J. G., Gay, C. C., & Gay, J. M. (1999). Partitioning the mortality risk associated with inadequate passive transfer of colostral immunoglobulins in dairy calves. Journal of Veterinary Internal Medicine, 13(4), 335-337.
22. Trotz-Williams, L. A., Leslie, K. E., & Peregrine, A. S. (2008). Passive immunity in Ontario dairy calves and investigation of its association with calf management practices. Journal of dairy science, 91(10), 3840-3849.
23. Vázquez-Flores, S.a , Geiger, A, Olamendi-Uresti, AE, Aguilar-López, DM, Díaz-Avila, LE. Lucio- Rodríguez, C. (2018) Determinación de IgG en suero sanguíneo de machos Holstein alimentados con calostro de vaquillas suplementado con calostro deshidratado. Journal of Dairy Science (aceptado)
24. Vega, C., Bok, M., Chacana, P., Saif, L., Fernandez, F., & Parreño, V. (2011). Egg yolk IgY: protection against rotavirus induced diarrhea and modulatory effect on the systemic and mucosal antibody responses in newborn calves. Veterinary immunology and immunopathology, 142(3), 156-169.
25. Wells, S. J., Dargatz, D. A., & Ott, S. L. (1996). Factors associated with mortality to 21 days of life in dairy heifers in the United States. Preventive Veterinary Medicine, 29(1), 9-19.
26. Wooding, F.B.P. and Flint, A.P.F. (1994) Placentation. Chapter 4 in G.E. Lamming, ed. Marshall's Physiology of Reproduction, 4th ed. 3(1): 233-460. Chapman & Hall, London.
27. Windeyer, M. C., Leslie, K. E., Godden, S. M., Hodgins, D. C., Lissemore, K. D., & LeBlanc, S. J. (2014). Factors associated with morbidity, mortality, and growth of dairy heifer calves up to 3 months of age. Preventive veterinary medicine, 113(2), 231-240.
28. Xu, M. L., Kim, H. J., & Kim, H. J. (2014). Effect of dietary bovine colostrum on the responses of immune cells to stimulation with bacterial lipopolysaccharide. Archives of pharmacal research, 37(4), 494-500.









