Influencia de la adición de extractos de taninos al inicio de la engorda en la carga por nemátodos en becerros en corral
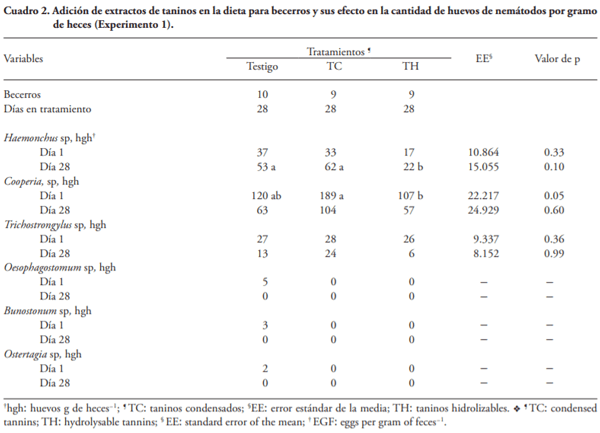
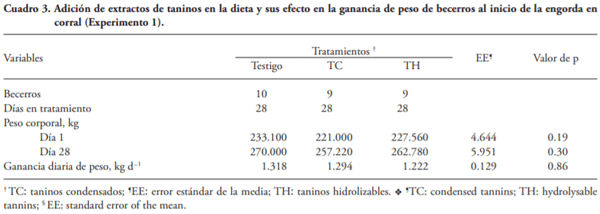
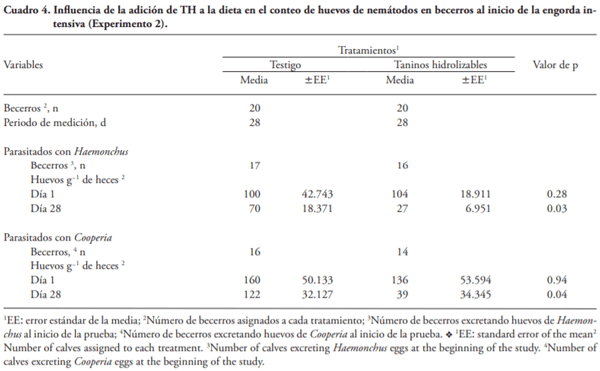
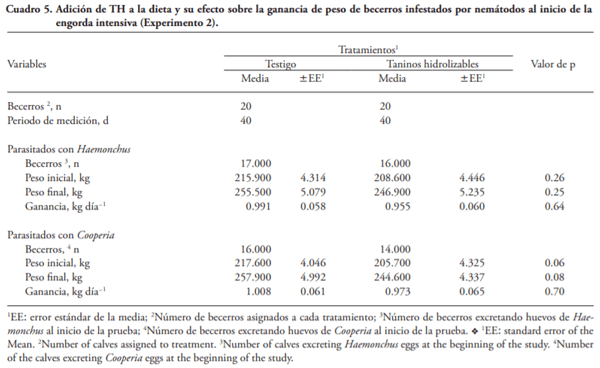
Las enfermedades ocasionadas por nemátodos afectan la salud y productividad de becerros en engorda. El consumo de plantas con taninos reduce la carga por nemátodos de rumiantes en pastoreo, pero hay poca información relacionada con el efecto de la adición de extractos de taninos (ET) a la dieta en la carga de nemátodos de becerros en corral. El objetivo de este estudio fue evaluar la influencia de la adición de ET en la carga por nemátodos en becerros al inicio de la engorda en corral. Experimento 1. Treinta becerros Brahman (227±13.9 kg) se alojaron en seis corraletas (6´12 m) con 24 m2 techo, 2.4 m de comedero y 0. 6 m de bebedero. El diseño experimental fue completamente al azar y los tratamientos fueron: 1) 0 % de ET (Testigo), 2) 6 g kg-1 MS ET condensados (TC), y 3) 6 g kg-1 MS de ET hidrolizables (TH). Muestras de heces se recolectaron 3 d antes y 3 d después de aplicar los tratamientos por 28 d. Los valores de los huevos por gramo de heces (hgh) fueron transformados a log10(n+40), y se analizaron por ANDEVA. Los TH disminuyeron en 58 % (p=0.10) los hgh de Haemonchus spp. Experimento 2. Con base en los resultados del Experimento 1, se duplicó el número de unidades experimentales y se aumentó 2.5 veces para probar la ausencia de efecto de TH en la excreción de huevos de Cooperia spp. El diseño experimental fue completamente al azar y se usaron 40 becerros Brahman (212±8.8 kg) alojados en ocho corraletas y los tratamientos fueron: 1) 0 % de ET (Testigo), y 2) 15 g kg-1 MS de TH. El procedimiento fue similar al Experimento 1, los valores de hgh fueron transformados a Log10(n+17), y se realizó un ANDEVA. La adición de 15 g kg-1 MS de TH disminuyó (p£0.05) en 61 y 68 % la cantidad de hgh de Haemonchus sp y de Cooperia sp, respectivamente. Los resultados sugieren que la inclusión de extracto de taninos hidrolizables en la dieta puede ser una alternativa sustentable para el control de nemátodos como Haemonchus en bovinos en engorda.
Palabras clave: Becerros, extractos de taninos, nemátodos, engorda.
Ames, E. R., R. Rubin, and J. K. Matsushima. 1969. Effect of gastrointestinal nematode parasites on performance of feedlot cattle. J. Anim. Sci. 28:698-704.
Arévalo, P. 2008. Taninos condensados en especies forrajeras y sus efectos en la productividad animal. Rev. Electr. Nutritime 5: 584-591.
Athanasiadou, S., O. Tzamaloukas, I. Kyriazakis, F. Jackson, and R. L. Coop. 2005. Testing for direct anthelmintic effects of bioactive forages against Trichostrongylus colubriformis in grazing sheep. Vet. Parasitol. 127: 233-243.
Bachaya, H. A., Z. Iqbal, M. N. Khan, A. Jabbar, A. H. Gilant, and Islam-Ud-Din. 2009. In vitro and in vivo anthelmintic activity of Terminalia arjuna bark. Int. J. Agr. Biol. 11: 273-278.
Beserra, L. M., C. M. Leal, S. Maia, A. L. Fernades, y L. T. Freitas. 2011. Plantas taaniniferas e o controle de nematoides gastrintestinais de pequenos ruminantes. Cienc. Rural 41: 1967-1974.
Borges, F. A., G. D. Almeida, R. P. Heckler, R. L. Lemes, M. K. V. Onizuka, and D. G. L. Borges. 2012. Anthelmintic resistance impact on tropical beef cattle productivity: effect on weight gain of weaned calves. Trop. Anim. Health Prod.44: 280-284.
Borloo, J., J. De Graef, I. Peelaers, D. L. Nguyen, M. Mitreva, B. Devreese, C. H. Hooke, J. Vercruysse, E. Claerebout, and P. Geldhof. 2013. In-depth proteomic and glycomic analysis of the adult-stage Cooperia oncophora excretome/secretome. J. Proteome Res. 12: 3900-3911.
Brake, D. W., E. C. Titgemeyer, E. A. Bailey, and D. E. Anderson. 2014. Small intestine digestion of raw cornstarch in cattle consuming a soybean hull-based diet is improved by duodenal casein infusion. J. Anim. Sci. 92: 4047-4056.
Bricarello, P. A., L. G. Zaros, L. L. Couthino, R. A. Rocha, F. N. J. Kooyman, E. De Vries, J. R. S. Consalves, L. G. Ling, A. V. Pires, and A. F. T. Amarante. 2007. Field study on nematode resistance in Nellore-breed cattle. Vet. Parasitol. 148: 272-278.
Butter, N.L, J.M. Dawson, D. Wakelin, and P.J. Buttery. 2000. Effect of dietary tannin and protein concentration on nematode infection (Trichostrongylus colubriformis) in lambs. J. Agr. Sci. 134: 89-99.
Calderón-Quintal, J. A., J. F. J. Torres-Acosta, C. A. SandovalCastro, M. A. Alonso, H. Hoste, and A. Aguilar-Caballero. 2010. Adaptation of Haemonchus contortus to condensed tannins: can it be possible?. Arch. Med. Vet. 42: 165-171.
Casciola, W., M. De la Iglesia, M. Favaro, M. Lamboglia, S. Uberti, J. Sosa, E. Reggiardo, I. Nescier, E. Elizalde, G. Fernandéz, y C. Boggero. 2009. Estudio del efecto de los taninos condensados sobre la producción y composición de la leche de oveja. Ciencias Agrar. 8: 29-34.
Coles, G. C., F. Jackson, W. E. Pomroy, R. K. Prichard, G. von Samsom-Himmelstjerna, A. Silvestre, M. A. Taylor, and J. Vercruysse. 2006. The detection of anthelmintic resitance in nematodes of veterinary importance. Vet. Parasitol. 136: 167-185.
De Graef, J., E. Claerebout, and P. Geldhof. 2013. Anthelmintic resistance of gastrointestinal cattle nematodes. Vlaams Diergen Tijds 82: 113-123.
Demeler, J., A. M. J. Van Zeveren, N. Kleinschmidt, J. Vercruysse, J. Höglund, R. Koopmann, J. Cabaret, E. Clarebout, M. Areskog, and G. von Samson-Himmelstjerna. 2009. Monitoring the efficacy of ivermectin and albendazole against gastro intestinal nematodes of cattle in Northern Europe. Vet. Parasitol. 160: 109-115.
FASS, 2010. Guide for the Care and Use of Agricultural Animals in Research and Teaching. Federation of Animal Science Societies. Champaign, IL.
Fernandéz, D., J. B. de Oliveira, S. Calderón, y J. J. Romero. 2008. Prácticas de diagnóstico y control de parásitos de caninos y felinos en 50 clínicas veterinarias del área metropolitan de Costa Rica. Ciencia Vet. 26: 51-71.
Fernandéz-Figueroa A., R. Arieta-Román, E. Graillet-Juárez, D. Romero-Salas, M. Romero-Figueroa, y I. Felipe-Ángel. 2015. Prevalencia de nemátodos gastroentéricos en bovinos doble propósito en 10 ranchos de Hidalgotitlan Veracruz, México. Abanico Vet. 5: 13-18.
Fluharty, F. L. and S. C. Loerch, 1996. Effects of Dietary energy source and level on performance of newly arrived feedlot calves. J. Anim. Sci. 74:504-513.
Frutos P., G. Hervás, F. J. Giraldez, y A. R. Mantecón. (2004). Tannins and ruminant nutrition. Span. J. Agric. Res. 2: 191- 202.
García, E. 1981. Modificaciones al Sistema de Clasificación Climática de Köppen. 3ª ed. México D.F. 91 p.
Gasbarre, L. C., L. L. Smith, J. R. Lichtenfels, and P. A. Pilitt. 2009. The identification of cattle nematode parasites resistant to multiple classes of anthelmintics in a commercial cattle population in the US. Vet. Parasitol. 166: 281-285.
Hicks, C. R. 1973. Fundamental Concepts in the Design of Experiments. Holt, Reinhart and Wiston, New York. 349 p.
Hutcheson, D. P., and N. A. Cole. 1986. Management of transit-stress syndrome in cattle: nutritional and environmental effects. J. Anim. Sci. 62:555-560.
INEGI, 2009. Anuario Estadístico del Estado de Sinaloa. Instituto Nacional de Estadística, Geografía e Informática. Aguascalientes, Aguascalientes, México.
Karanikola, S. N., J. Krücken, S. Ramünke, T. de Waa, J. Höglund, J. Charlier, C. Weber, E. Müller, S. J. Kowalczyk, J. Kaba., and G. von Samsom-Himmelstjerna. 2015. Development of a multiplex fluorescence immunological assay for the simultaneous detection of antibodies against Cooperia oncophora, Dictyocaulus viviparus and Fasciola hepatica en cattle. Parasites & Vectors 8:335. DOI: 10.1186/s13071- 015-0924-0.
Krueger, W.K., H. Gutiérrez-Bañuelos, G. E. Carstens, B R. Min, W. E. Pinchak, R. R. Gomez, R. C. Anderson, N. A. Krueger, and T. D. A. Forbes. 2010. Affects of dietary tannin source on performance, feed efficiency, ruminal fermentation, and carcass and non-carcass traits in steers fed a highgrain diet. Anim. Feed Sci. Technology 159: 1-9.
Lem, M. F., K. P. Vincent, W. P. Josue, Y. Jeannette, M. T. Gertrude, and T. Joseph. 2014. In vitro ovicidal and larvicidal activities of stem bark of Terminalia glaucescens (Combretaceae) against Haemonchus contortus. Am. J. Plant Sci. 5: 2859-2868.
Min, B. R. and S. P. Hart. 2003. Tannins for suppression of internal parasites. J. Anim. Sci. 81: 102-109.
Morales, G., L. A. Pino, E. Sandoval, D. Jiménez, y J. Morales. 2013. Relación entre la condición corporal y el nivel de infestación parasitaria en bovinos a pastoreo como criterio para el tratamiento antihelmíntico selectivo. Rev. Inv. Vet. Perú. 23: 80-89.
Niezen, J. H., T. S. Waghorn, W. A. G. Charleston and G. C. Waghorn. 1995. Growth and gastrointestinal nematode parasitism in lambs grazing either lucerne (Medicago sativa) or sulla (Hedysarumcoronarium) which contains condensed tannins. J. Agr. Sci. 125: 281-289.
NRC. 2000. Nutrient Requirements of Beef Cattle. (7th Revised Ed.) National Academy Press, Washington, D. C. 248 p.
Olivares, P. J., G. Segura, y M. T. Valencia. 2006. Prevalencia de nematodos gastroentéricos en terneros predestete del trópico de Guerrero, México, durante la época lluviosa. RED-VET 7: 1-5.
Otero, M. J., y L. G. Hidalgo. 2004. Taninos condensados en especies forrajeras de clima templado: efectos sobre la productividad de rumiantes afectados por parasitosis gastrointestinales. Sitio Arg. Prod. Anim. 16: 1-11.
Pfukenyi, D. M., S. Mukaratirwa, A. L. Willingham, and J. Monrad. 2007. Epidemiological studies of parasitic gastrointestinal nematodes, cestodes and coccidia infections in cattle in the highveld and lowveld communal grazing areas of Zimbabwe. Onderstepoort J. Vet. Res. 74: 129-142.
Quijada, J., C. Fryganas, H. M. Ropiak, A. Ramsay, I. MuellerHarvey, and H. Hoste. 2015. Anthelmintic Activities against Haemonchus contortus or Trichostrongylus colubriformis from small ruminants are influenced by structural features of condensed tannins. J. Agric. Food Chem. 63: 6346-6354.
Rivera-Méndez, C.R., A. Plascencia, N. Torrentera, and R. A. Zinn. 2016. Effect of level and source of supplemental tannin on growth-performance of Holstein steers during the late finishing phase. J. Appl. Anim. Res. In press.
Roeber, F., A. R. Jex, and R. B. Gasser. 2013. Impact of gastrointestinal parasitic nematodes of sheep, and the role of advanced molecular tools for exploring epidemiology and drug resistance – an Australian perspective. Parasites & Vectors 6: 153. http://www.parasitesandvectors.com/content/6/1/153.
Sandoval, E., G. Morales, N. Ybarra, M. Barrios, y J. Borges. 2011. Comparación entre dos modelos diferentes de cámaras de McMaster empleadas para el conteo coproscópico en el diagnóstico de infecciones por nemátodos gastroentéricos en rumiantes. Zootec. Trop. 29: 495-501.
Sato, M. O., M. Sato, K. Chaisiri, W. Maipanich, T. Yoonuan, S. Sanguankiat, T. Pongvongsa, B. Boupha, K. Moji, yand J. Waikagul. 2014. Nematode infection among ruminants in monsoon climate (Ban-Lahanam, Lao PDR) and its role as food-borne zoonosis. Braz. J. Vet. Parasitol. 23: 80-84.
Seo, H. L., L. C. P. M. Filho, L. A. Honorato, B. F. da Silva, A. F. T. do Amarante, and P. A. Bricanello. 2015. The effect of gastrointestinal nematode infection level on grazing distance from dung. Plus One, DOI: 10.137/journal.pone.0126340.
Silva-Díaz, H., J. Monteza-Salazar, and A. Rentería-Valle. 2015. Elisa y examen microscópico directo en la detección de Giardia en muestras fecales de niños en Chongoyape, Chiclayo, Perú. Rev. Exp. Med. 1: 5-9.
Statistix. 2007. Statistix User´s Manual, Release 9.0. Analytical Software, Tallahassee, FL. Sutherland I. A., and D. M. Leathwick. 2011. Anthelmintic resistance in nematode parasites of cattle: a global issue?. Trends Parasitol. 27: 176-181.
Torres, A. J. F., M. A. Alonso, H. Hoste, C. A. Sandoval, A., y J. Aguilar. 2008. Efectos negativos y positivos del consumo de forrajes ricos en taninos en la producción de caprinos. Trop. Subtrop. Agroecosyt. 9: 83-90.
Vázquez, A. A., E. Alvarez, J. A. López, A. Wall, y L. A. De la Rosa. 2012. Taninos hidrolizables y condensados: naturaleza quimica, ventajas y desventajas de su consumo. Tecnociencia Chihuahua 6: 84-93.
Zarrin M., M. Rahdar, and A. Gholamian. 2015. Biological control of the nematode Infective larvae of Trichostrongylidae family with filamentous fungi. Jundishapur J. Microbiol. 8:e17614 DOI: 10.5812/jjm.17614.











