
Metapneumovirus aviar (aMPV)
El Metapneumovirus aviar (aMPV) está asociado a infecciones del sistema respiratorio superior de aves comerciales, ocasionando una enfermedad respiratoria principalmente en pavos y pollos, aunque otras especies como faisanes y patos domésticos también pueden verse afectadas. La infección se caracteriza por generar sintomatología respiratoria leve a moderada, mortalidad baja y alteraciones reproductivas en gallinas ponedoras o reproductoras. El aMPV actúa como un agente primario que facilita la presentación de infecciones secundarias por bacterias oportunistas, aumentando así la mortalidad en el grupo de aves afectadas. Se reconoce como uno de los limitantes para la producción avícola en el mundo, debido al impacto económico asociado a pérdidas por retraso en el crecimiento y/o la disminución en la producción y calidad del huevo.
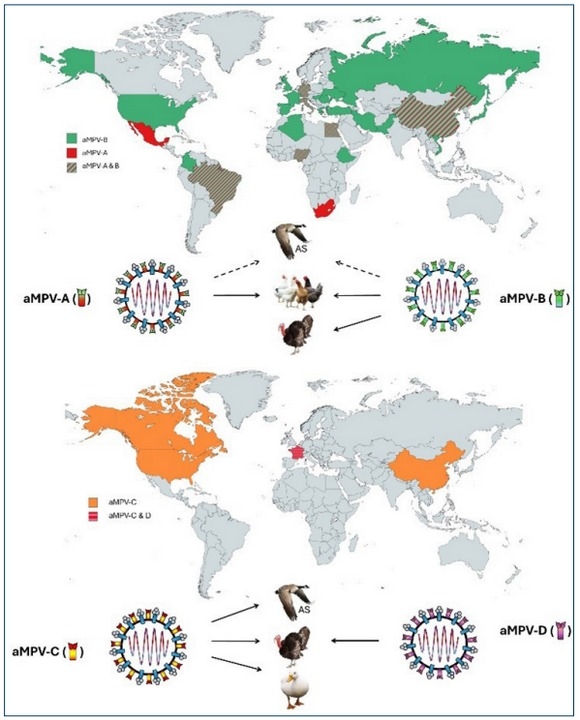
Figura 1. Distribución geográfica y hospederos de los seis subtipos del aMPV descritos alrededor del mundo. Las flechas completas indican que el subtipo genera enfermedad en las aves señaladas y la flecha segmentada indica que las aves son portadoras del virus. AS: Aves silvestres. (a.) Linage Americano del aMPV-C. (b.) Linage euroasiático del aMPV- C.
El aMPV es un virus envuelto de ARN monocatenario con polaridad negativa que pertenece a la familia Pneumoviridae y al género Metapneumovirus, en el que se reconocen dos especies: aMPV y Metapneumovirus humano (hMPV). El genoma del aMPV tiene un tamaño variable, que oscila entre 13 a 15 kb según el subtipo (5). Este codifica para ocho proteínas estructurales: nucleoproteína (N), fosfoproteína (P), proteína de matriz (M), proteína de fusión (F), proteína M2 (M2), glicoproteína G (G), proteína hidrofóbica pequeña (SH) y proteína polimerasa grande (L), organizadas con la siguiente disposición: 3’-N-P-M- F-M2-SH-G-L-5’ (Figura 2).
Cada uno de los componentes del genoma cumple con una función específica. La proteína N envuelve y protege el ARN viral formando la nucleocápside, el componente más importante de la cápside viral. Las proteínas P, M2 y L están asociadas a la nucleoproteína y forman el complejo ribonucleoproteína. Dentro de éstos, la proteína P actúa como un cofactor de la proteína L y en el aMPV-C se ha demostrado que desempeña un papel en la inhibición de la respuesta de interferón (INF) del hospedero. Esta interacción antagónica al sistema inmune es importante ya que puede facilitar la replicación del virus, aumentando la carga viral que se excreta al ambiente y posteriormente ocasionar un mayor daño del tejido respiratorio. La proteína M es la encargada de organizar el ensamblaje del virus y envolver la nucleoproteína y se encuentra cubierta por una capa lipídica que contiene las tres glicoproteínas de membrana: F, SH y G. Estas tres glicoproteínas del virus son importantes ya que se consideran factores determinantes del tropismo, la antigenicidad y la virulencia. En el proceso de infección a la célula blanco, después de la fusión, la nucleocápside viral entra al citoplasma del hospedero para su replicación, en donde las proteínas N, P, M, M2 y L forman el complejo polimerasa, encargado de la mayoría de los procesos enzimáticos involucrados en la transcripción y la replicación. Se han identificado diferencias en la secuencia de nucleótidos, aminoácidos, y el tamaño del genoma entre los subtipos del aMPV, en donde se reconoce al gen de la glicoproteína G como el más variable y al gen N como el más conservado (6), siendo esto relevante desde el punto de vista diagnóstico.
La proteína F es una glicoproteína de membrana que media la infección al facilitar la fusión entre la envoltura viral y las membranas de las células del hospedero, reconociéndose como el determinante principal del tropismo del virus a las células del sistema respiratorio de las aves. Esta glicoproteína se encarga además de la fusión del virus con los receptores αvβ1 de integrinas de las células del sistema respiratorio del hospedero, dando así inicio a la infección. La glicoproteína G a su vez, se ha relacionado con la evasión del sistema inmune y con la adhesión del virus a la membrana de las células blanco. Otra glicoproteína, la proteína SH, se propone actúa como una viroporina, facilitando la invasión del virus a las células del hospedero al aumentar la permeabilidad de la membrana celular (7–9).
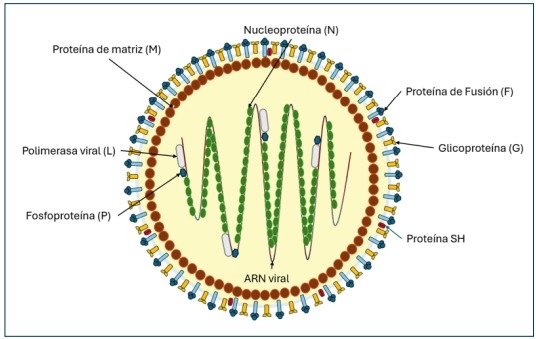
Figura 2. Representación de la estructura viral del aMPV. En la imagen están representadas las proteínas estructurales codificadas en el genoma viral: nucleoproteína (N), fosfoproteína (P), proteína de matriz (M), proteína de fusión (F), glicoproteína G (G), proteína hidrofóbica pequeña (SH) y proteína polimerasa grande (L). Adicionalmente se encuentra la proteína M2 (M2) como parte de las ocho proteínas estructurales.
La infección por aMPV inicia con la replicación del virus en el epitelio respiratorio y el reclutamiento de células linfoides, generando lesiones en la mucosa del sistema respiratorio superior. El daño al tejido respiratorio se caracteriza por descamación epitelial, pérdida de la actividad ciliar y necrosis, lo que favorece la colonización por agentes bacterianos secundarios (10,11).
En pollos, el diagnóstico de la infección por aMPV es más d0esafiante debido a que la enfermedad se manifiesta con signos respiratorios menos evidentes, a los cuales están comúnmente asociados los subtipos aMPV-A y el B. En algunos casos se puede observar secreción oculonasal e inflamación del tejido periorbitario y de los senos infraorbitarios. En casos severos pueden presentarse signos neurológicos como torticolis, desorientación y opistótonos. Sin embargo, en muchos casos las aves no desarrollarán síntomas aparentes, pasando desapercibidas. Por otra parte, en gallinas y pavas ponedoras se pueden observar alteraciones como decoloración y fragilidad de la cáscara junto con disminución en la producción de huevo del 30 al 70%. Estas alteraciones reproductivas pueden aparecer con o sin síntomas respiratorios (14,15).
Es importante considerar que los signos respiratorios y reproductivos no son únicos del aMPV, ya que otros agentes virales relacionados con el CRA como el virus de la Enfermedad de Newcastle (NDV), el de la Bronquitis Infecciosa (BIA) y la Laringotraqueitis Aviar (LTA), al igual que agentes bacterianos como Mycoplasma spp, Ornithobacterium rhinotracheale, Avibacterium paragallinarum, entre otros, pueden producir cuadros clínicos similares. Asimismo, la infección por aMPV puede verse exacerbada por agentes bacterianos como: Escherichia coli, Bordetella avium y Mycoplasma gallisepticum. También, puede encontrarse en coinfección con virus como el de la enfermedad de Gumboro (IBDV), IBV y NDV (16).
En cuanto a la transmisión, esta ocurre de forma horizontal, especialmente asociada a fallas en bioseguridad, como resultado del contacto directo con las secreciones y aerosoles de animales infectados o mediante fómites contaminados (materiales de cama, comida, agua, vehículos y personas), los cuales también pueden estar implicados en la transmisión del virus dentro de una granja y sus alrededores. Adicionalmente, se ha confirmado que las aves silvestres desempeñan un papel en la transmisión y diseminación del virus alrededor del mundo. Esto se debe al contacto, en algunos casos cercanos, de aves comerciales con poblaciones de aves silvestres y/o la contaminación de cuerpos de agua cercanos. Hasta el momento no existen suficientes evidencias para confirmar la transmisión vertical del virus (Figura 3).
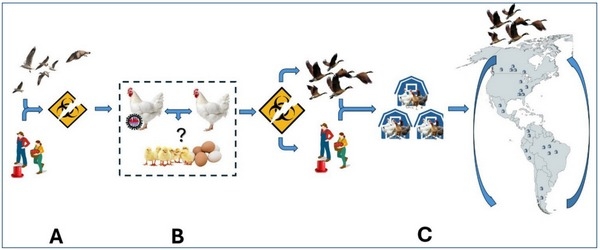
Figura 3. Aspectos epidemiológicos propuestos de la transmisión del virus. A: Esquema de entrada a una producción avícola por una posible brecha en la bioseguridad. B: Aumento de la carga viral mediante la transmisión horizontal entre aves infectadas dentro de un núcleo, contemplando la posibilidad no demostrada de una trasmisión vertical. C: Salida del virus hacia granjas vecinas y posteriormente diseminación regional facilitada por las rutas migratorias de aves silvestres.
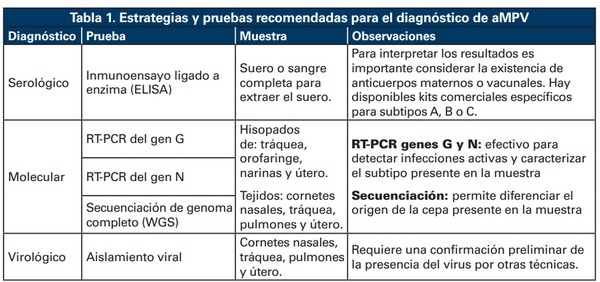
El diagnóstico comienza con la identificación de signos respiratorios o reproductivos compatibles con infección por aMPV. Dentro de las estrategias diagnósticas, la detección molecular se utiliza con mayor frecuencia que el aislamiento viral, por ser una herramienta más sensible y menos dispendiosa. No obstante, la detección del virus suele ser difícil debido al corto periodo de excreción en animales infectados, que ocurre entre los tres a los 10 días post infección (DPI) y a la sintomatología observada que puede ser de leve a inaparente. Con base en lo anterior, se debería realizar la toma de muestras para diagnóstico molecular tan pronto como se observen los signos clínicos. Se recomienda colectar hisopados de tracto respiratorio y reproductivo, bien sea individuales o en pooles de no más de cinco aves de un mismo galpón. En el caso de pruebas moleculares, se puede detectar el ARN viral hasta los nueve DPI en tráquea y 14 DPI en cornetes nasales (17,18).
Para la detección y caracterización molecular del aMPV se emplea la PCR con Retrotranscriptasa Reversa (RT-PCR). Esta prueba provee una sensibilidad y especificidad cercana al 100%, siendo ideal para la identificación de los subtipos del virus. Para la detección del aMPV se han empleado como blancos de amplificación los genes N y G. En este sentido, el gen N puede proveer una mayor capacidad de detectar el virus, incluso en aves silvestres; sin embargo, no permite la caracterización de los subtipos detectados. A su vez, el gen G ha sido muy útil para la detección y la diferenciación del subtipo A y B en países en los que los dos subtipos pueden estar circulando. Por lo anterior, se proponen estrategias de detección en dos fases, en donde en una primera instancia se utiliza el gen N lo que permite establecer la presencia de cualquiera de los subtipos y posterior a esto, las muestras que resulten positivas serán sometidos a caracterización teniendo como blanco el gen G.
Lo anterior debido a que la caracterización del subtipo presente en la muestra es casi tan importante como su detección, ya que permite plantear y orientar estrategias vacunales efectivas para el control de la enfermedad en una región (19,20). En la tabla 1 se resumen las técnicas disponibles para el diagnóstico de aMPV.
Para realizar diagnóstico histopatológico y aislamiento viral, dependiendo del tipo de sistema productivo, se puede realizar necropsia orientada a los órganos respiratorios (cornetes, tráquea, pulmones y sacos aéreos) y reproductivos. En los casos en donde se presente una infección secundaria que haya generado un daño más extenso en los tejidos del sistema respiratorio superior, es probable que el virus ya no pueda ser detectado. Esto se debe a que, a medida que la destrucción del epitelio progresa a causa de la infección secundaria, el virus perderá gradualmente espacio para replicarse debido a una menor proporción de células relativamente sanas. En este escenario se puede complicar el diagnóstico, ya que los signos clínicos podrán ser causados por la infección secundaria, mientras que cada vez será menos posible detectar el virus (1,21).
El diagnóstico serológico es muy útil para la confirmación de la infección en animales que ya pasaron por el periodo de excreción viral, siendo ELISA indirecta el método más utilizado. La sensibilidad de la prueba dependerá principalmente del subtipo y el antígeno utilizado. Es necesario tener en cuenta las limitaciones en la detección de los anticuerpos y por tanto en el diagnóstico serológico cuando se usan antígenos de cepas heterólogas del virus presente, incluso cuando pueda existir proximidad filogenética entre las cepas.
Se han desarrolladlo kits de ELISA competitiva utilizando anticuerpos monoclonales sintéticos que pueden aumentar la sensibilidad y la especificidad de la prueba; sin embargo, es importante considerar al subtipo circulante en la región para la selección del kit (22).
Una de las estrategias de control para aMPV se basa en el uso de vacunas que tienen como objetivo principal disminuir la presentación de signos y la mortalidad en pavos y pollos, frente a la infección por cepas virulentas de campo. En este sentido, se han desarrollado y utilizado vacunas comerciales vivas atenuadas e inactivadas. Las vacunas vivas atenuadas de los subtipos A, B y C son de amplio uso en Europa, Asia, Estados Unidos y en algunas partes de Latinoamérica. Estas inducen una respuesta inmune local rápida seguida por la inmunidad celular (3). Sin embargo, los planes vacunales para una región se deben fundamentar en datos epidemiológicos de los subtipos y las cepas circulantes del virus.
Las vacunas vivas atenuadas para aMPV-B pueden conferir protección homóloga y heteróloga para aMPV-B y aMPV-A. Se dispone igualmente de vacunas inactivadas que se emplean como refuerzo a las vacunas vivas buscando ampliar la protección de las aves en edad adulta. Se ha reportado que los anticuerpos maternos pueden retrasar o incluso interferir con la generación de anticuerpos vacunales, especialmente en pollos donde la respuesta humoral tiende a ser deficiente tras la primera vacunación. Sin embargo, eso no significa que las aves no puedan desarrollar la inmunidad de forma tardía después de la aplicación de la vacuna (23).
Recientemente se han propuesto y evaluado diferentes estrategias innovadoras para el desarrollo de vacunas contra aMPV, como la utilización de otros virus vectores de proteínas estructurales del aMPV. Algunos ejemplos incluyen la inserción del gen de la proteína F dentro del genoma de una cepa vacunal del virus de la viruela aviar y del gen de la proteína G dentro del genoma de una cepa vacunal de NDV. No obstante, además de la vacunación, el control del virus debe estar acompañado por medidas de bioseguridad apropiadas en las granjas, teniendo en cuenta que esto representa un factor de riesgo mayor en la introducción del virus a la granja y en la transmisión del virus (24).
1. Jones, R.C.; Rautenschlein, S. Avian Metapneumovirus. Diseases of Poultry. 13th. Ames, Iowa 2013, 125–138.
2. Croville, G.; Foret, C.; Heuillard, P.; Senet, A.; Delpont, M.; Mouahid, M.; Ducatez, M.F.; Kichou, F.; Guerin, J.L. Disclosing Respiratory Co-Infections: A Broad-Range Panel Assay for Avian Respiratory Pathogens on a Nanofluidic PCR Platform. Avian Pathology 2018, 47, 253–260, doi:10.1080/03079457.2018.1430891.
3. Kaboudi, K.; Lachheb, J. Avian Metapneumovirus Infection in Turkeys: A Review on Turkey Rhinotracheitis. Journal of Applied Poultry Research 2021, 30, 100211, doi:10.1016/j.japr.2021.100211.
4. Jesse, S.T.; Ludlow, M.; Osterhaus, A.D.M.E. Zoonotic Origins of Human Metapneumovirus: A Journey from Birds to Humans. Viruses 2022, 14, doi:10.3390/v14040677.
5. Rima, B.; Collins, P.; Easton, A.; Fouchier, R.; Kurath, G.; Lamb, R.A.; Lee, B.; Maisner, A.; Rota, P.; Wang, L. ICTV Virus Taxonomy Profile: Pneumoviridae. Journal of General Virology 2017, 98, 2912–2913, doi:10.1099/ jgv.0.000959.
6. Brown, P.A.; Lemaitre, E.; Briand, F.X.; Courtillon, C.; Guionie, O.; Allée, C.; Toquin, D.; BayonAuboyer, M.H.; Jestin, V.; Eterradossi, N. Molecular Comparisons of Full Length Metapneumovirus (MPV) Genomes, Including Newly Determined French AMPV-C and - D Isolates, Further Supports Possible Subclassification within the MPV Genus. PLoS One 2014, 9, doi:10.1371/journal.pone.0102740.
7. Yun, B.L.; Guan, X.L.; Liu, Y.Z.; Zhang, Y.; Wang, Y.Q.; Qi, X. Le; Cui, H.Y.; Liu, C.J.; Zhang, Y.P.; Gao, H.L.; et al. Integrin Αvβ1 Modulation Amects Subtype B Avian Metapneumovirus Fusion Protein-Mediated CellCell Fusion and Virus Infection. Journal of Biological Chemistry 2016, 291, 14815–14825, doi:10.1074/jbc. M115.711382.
8. Bao, X.; Kolli, D.; Esham, D.; Velayutham, T.S.; Casola, A. Human Metapneumovirus Small Hydrophobic Protein Inhibits Interferon Induction in Plasmacytoid Dendritic Cells. Viruses 2018, 10.
9. Govindarajan, D.; Kim, S.; Samal, S.K.; Govindarajan, D.; Kim, A.S.; B, S.K.S. Contribution of the Attachment G Glycoprotein to Pathogenicity and Immunogenicity of Avian Metapneumovirus Subgroup C Contribution of the Attachment G Glycoprotein to Pathogenicity and Immunogenicity of Avian Metapneumovirus Subgroup C. 2010, 54, 59–66.
10. Gough, R.E.; Collins, M.S.; Cox, W.J.; Chettle, N.J. Experimental Infection of Turkeys, Chickens, Ducks, Geese, Guinea Fowl, Pheasants and Pigeons with Turkey Rhinotracheitis Virus. Vet Rec 1988, 123, 58–59, doi:10.1136/vr.123.2.58.
11. Brown, P.A.; Allée, C.; Courtillon, C.; Szerman, N.; Lemaitre, E.; Toquin, D.; Mangart, J.M.; Amelot, M.; Eterradossi, N. Host Specificity of Avian Metapneumoviruses. Avian Pathology 2019, 48, 311–318, doi:10.1080/03079457.2019.1584390.
12. Luqman, M.; Duhan, N.; Temeeyasen, G.; Selim, M.; Jangra, S.; Mor, S.K. Geographical Expansion of Avian Metapneumovirus Subtype B: First Detection and Molecular Characterization of Avian Metapneumovirus Subtype B in US Poultry. Viruses 2024, 16, 508, doi:10.3390/v16040508.
13. Velayudhan, B.T.; McComb, B.; Bennett, R.S.; Lopes, V.C.; Shaw, D.; Halvorson, D.A.; Nagaraja, K. V. Emergence of a Virulent Type C Avian Metapneumovirus in Turkeys in Minnesota. Avian Dis 2005, 49, 520–526, doi:10.1637/7388-052805R.1.
14. Hartmann, S.; Sid, H.; Rautenschlein, S. Avian Metapneumovirus Infection of Chicken and Turkey Tracheal Organ Cultures: Comparison of Virus–Host Interactions. Avian Pathology 2015, 44, 480–489, doi:1 0.1080/03079457.2015.1086974.
15. Tucciarone, C.M.; Franzo, G.; Lupini, C.; Alejo, C.T.; Listorti, V.; Mescolini, G.; Brandão, P.E.; Martini, M.; Catelli, E.; Cecchinato, M. Avian Metapneumovirus Circulation in Italian Broiler Farms. Poult Sci 2018, 97, 503–509, doi:10.3382/ps/pex350.
16. Buys, S.B.; du Preez, J.H.; Els, H.J. The Isolation and Attenuation of a Virus Causing Rhinotracheitis in Turkeys in South Africa. Onderstepoort J Vet Res 1989, 56, 87–98.
17. Ball, C.; Manswr, B.; Herrmann, A.; Lemiere, S.; Ganapathy, K. Avian Metapneumovirus Subtype B Vaccination in Commercial Broiler Chicks: Heterologous Protection and Selected Host Transcription Responses to Subtype A or B Challenge. Avian Pathology 2022, 51, 181–196, doi:10. 1080/03079457.2022.2036697.
18. OIE Turkey Rhinotracheitis - Avian Metapneumovirus Infections. OIE Terrestrial Manual 2022, 1–18.
19. Chacón, J.L.; Brandão, P.E.; Buim, M.; Villarreal, L.; Ferreira, A.J.P. Detection by Reverse Transcriptase-Polymerase Chain Reaction and Molecular Characterization of Subtype B Avian Metapneumovirus Isolated in Brazil. Avian Pathology 2007, 36, 383–387, doi:10.1080/03079450701589142
20. Franzo, G.; Legnardi, M.; Mescolini, G.; Tucciarone, C.M.; Lupini, C.; Quaglia, G.; Catelli, E.; Cecchinato, M. Avian Metapneumovirus Subtype B around Europe: A Phylodynamic Reconstruction. Vet Res 2020, 51, 1–10, doi:10.1186/s13567-020- 00817-6
21. Gharaibeh, S.M.; Algharaibeh, G.R. Serological and Molecular Detection of Avian Pneumovirus in Chickens with Respiratory Disease in Jordan. Poult Sci 2007, 86, 1677– 1681, doi:10.1093/ps/86.8.1677
22. Xu, W.; Suderman, M.; Koziuk, J.; Ojkic, D.; Berhane, Y. Development of A Recombinant Nucleocapsid Based Indirect ELISA for the Detection of Antibodies to Avian Metapneumovirus Subtypes, A, B, and C. Vet Immunol Immunopathol 2021, 231, 110151, doi:10.1016/j.vetimm.2020.110151.
23. Rubbenstroth, D.; Rautenschlein, S. Investigations on the Protective Role of Passively Transferred Antibodies against Avian Metapneumovirus Infection in Turkeys. Avian Pathology 2009, 38, 427–436, doi:10.1080/03079450903349204.
24. Hu, H.; Roth, J.P.; Estevez, C.N.; Zsak, L.; Liu, B.; Yu, Q. Generation and Evaluation of a Recombinant Newcastle Disease Virus Expressing the Glycoprotein (G) of Avian Metapneumovirus Subgroup C as a Bivalent Vaccine in Turkeys. Vaccine 2011, 29, 8624–8633, doi:10.1016/j.vaccine.2011.09.007.








